精選版 日本国語大辞典 「錯体」の意味・読み・例文・類語
さく‐たい【錯体】
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
翻訳|complex
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
錯体は狭義から広義にわたり多様に定義されている。錯体を構成する化学種の電荷を考慮すると複雑になるので便宜上これを無視し,比較的狭い定義を与えるとすればつぎのようになる。〈一つあるいはそれ以上の,金属を主とする原子を中心として,これにいくつかの非金属原子あるいは原子団が結合してできた化学種を錯体という〉。中心原子は一つのものがふつうで,これを一核錯体または単核錯体という。中心原子が複数個のものを多核錯体といい,中心原子の数nに応じてn核錯体(二核錯体の場合には複核錯体ともいう)という。中心原子に結合する原子あるいは原子団を配位子ligandまたはリガンドという。配位子に含まれる原子のうち中心原子に直接結合している原子を配位原子と呼び,その数を配位数という。錯体にはイオンと分子とがある。錯イオンは陽イオンまたは陰イオンの形で存在する錯体で,対イオンと結合して錯塩,錯酸,錯塩基をつくる。これらと錯分子とをひとまとめにしたものが狭義の錯化合物で,配位化合物ともいう。ふつうの錯体(ウェルナー錯体という)においては配位原子は孤立電子対で中心原子に配位結合で結合している。したがってG.N.ルイスの酸・塩基の定義により,中心原子はルイス酸であり,配位子はルイス塩基である。このような錯体をウェルナー錯体と呼ぶ。これに対して配位子のもつπ電子が中心金属に供与されている錯体が最近きわめて多くつくられており,これらはπ錯体と呼ばれている(〈π錯体〉〈サンドイッチ化合物〉の項参照)。
ジメチル水銀Hg(CH3)2のように金属原子に対して炭化水素基が炭素で直接結合している有機金属化合物,あるいは2価炭素遊離基カルベンを含む錯体は,ウェルナー錯体とは別に取り扱われるのがふつうである。またOs5(CO)16のような金属クラスター化合物は,Os原子が5個直接結合してできた中心核に対してCOが配位した多核錯体であるが,性質等がかなり異なるので別に論ずる場合が多い。これらのウェルナーの配位説によって説明できないような錯体のことを非ウェルナー錯体という。錯体の定義において中心原子を金属に限った場合に,できた錯体を金属錯体と呼ぶことがある。中心原子に制限を加えないとCH4やH2Oなども錯体となって困ることがあるが,[BF4]⁻や[PF6]⁻などが入り無機化合物の形を統一的に説明するためには都合がよい。また配位結合を重視し,〈錯体とは配位結合を含むとみなされる化学種である〉とする定義もある。さらに,錯塩等も錯体中に含めることがあり,こうすると塩,分子,イオン等の区別を考えずに使える利点がある。なおベンゼンのような電子供与体が電荷移動力によってヨウ素のような電子受容体と結合してできるものは電荷移動錯体といい,広く定義した錯体の中に入るが,性質等がまったく異なるので別に取り扱われる。
1704年最初に発見された錯体は鉄(Ⅱ)と鉄(Ⅲ)のシアノ錯体である顔料のベルリン青であるといわれている。配位子としてNH3を含むアンミン錯体の最初のものはタサエールB.M.Tassaert(1798)の報告したCoCl3・6NH3である。その後多数のアンモニア錯塩がつくられ,その構造に対してスウェーデンのブロムストランドC.W.Blomstrand(1869)は鎖状構造式を与えた。ヨルゲンセンS.M.Jørgensen(1885)はこれを改良したが異性現象を説明できなかった。1893年A.ウェルナーが立体構造を考えて初めて異性現象を説明し,錯体化学(錯塩化学あるいは配位化学ともいう)の基礎を築いた(〈配位説〉の項参照)。ウェルナーの研究室で1911-12年に研究した柴田雄次が帰国後,錯体の吸収スペクトルを系統的に研究したのが日本における錯体化学の始まりである。
配位子には配位原子を1個だけしかもっていないもの(単座配位子あるいは一座配位子)と,複数個もつもの(多座配位子)とがある(錯体中での配位原子の位置を配位座とよぶ。〈座〉はこれからきている)。後者は配位原子の数nに応じてn座配位子と呼ばれる。一つの中心原子に配位してキレート錯体をつくる多座配位子のことをキレート配位子という(〈キレート化合物〉〈キレート試薬〉の項参照)。n座配位子は一つの中心原子に対していつもn座配位するとは限らず,nより少ない多座あるいは単座配位子となりうる。
錯体化学でよく出てくる簡単な配位子を表1に記す。配位子名は,一般に陰イオン性配位子は英語名に-oをつけ,中性および陽イオン性配位子はそのまま使う。ただし慣用名があるので注意を要する。複雑な配位子は略号を使うことが多い。表2におもなものをあげる。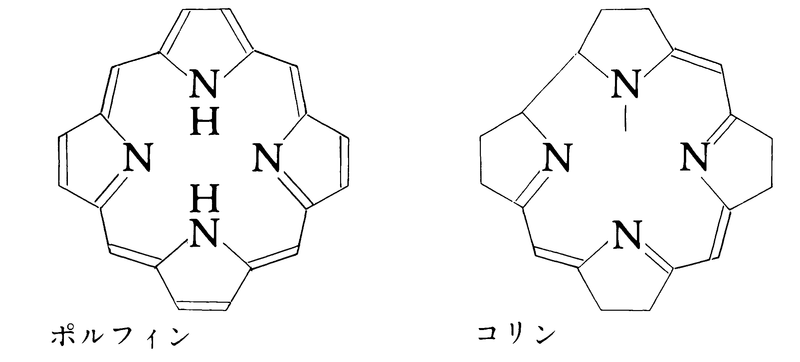
1, 7-CTHは1960年ころにつくられた環状四座配位子で種々の金属と安定な錯体を形成するが,自然界に存在する巨大環状配位子錯体であるクロロフィルやヘムの骨格であるポルフィンあるいはシアノコバラミン(ビタミンB12)の骨格であるコリンと似ていて興味深い。
変わった配位子としては69年発見されたクリプタンド(錯体をクリプタートという)やクラウンがあり,アルカリ金属やアルカリ土類金属と錯体をつくる。これらの配位子は生体内におけるアルカリ金属イオンの伝送に関与する大環状エステル,ノナクチンのモデル化合物として重要である。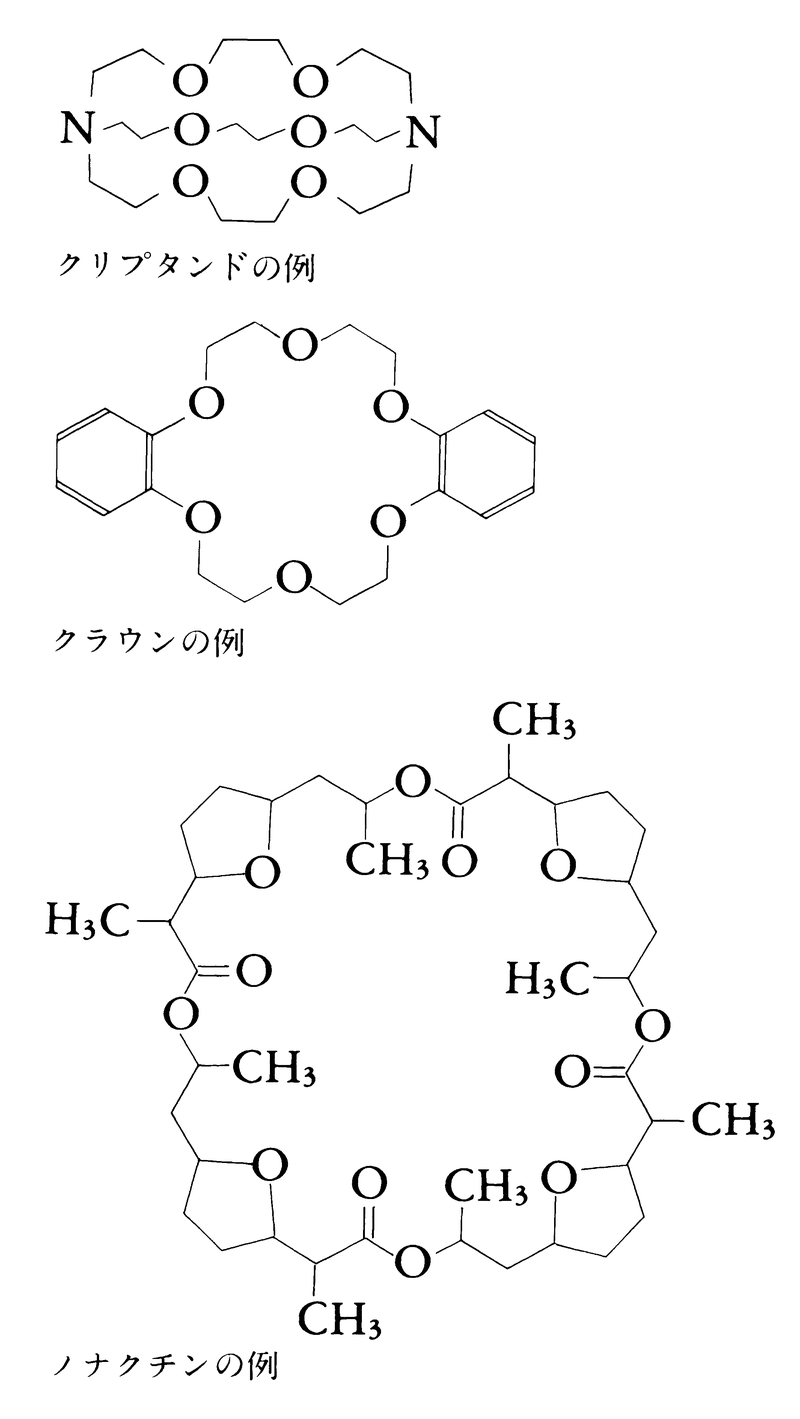
錯体の中心原子をMとし,配位原子をLとしたとき,MとLに関しての立体構造は,配位数2以上の場合には複数の可能性がある。配位数2の場合は,[Ag(NH3)2]⁺,[CuCl2]⁻のようにL-M-Lが直線形のものと,SnCl2,PbCl2のように折れ線形のものとがある。配位数3の場合は,[Cu{SP(CH3)3}3]⁺のようにMがL3平面上にある正三角形と,AsO33⁻,SbI3のようにMがL3平面から離れた三方錐形とがある。配位数4の場合は,[CoCl4]2⁻,[Zn(NH3)4]2⁺のような正四面体形と,[Pt(NH3)4]2⁺,[Ni(CN)4]2⁻のような平面正方形とがある。正方錐形の実例はない。配位数5の場合は,主要なものに[CuCl5]3⁻,[Fe(CO)5]のような三方両錐形と,[VO(H2O)4]2⁺,[InCl5]2⁻,[Ni(CN)5]3⁻のような正方錐形があり,特別な形として平面五角形の珍しい例が[Te(S2COC2H5)3]⁻(配位子の一つは単座配位)にみられる。配位数6の場合は,正八面体形,正三方柱形,五方錐形,六方錐形,平面六角形などが考えられるが,実際に知られているのは前の三つであり,大部分は正八面体形であって,錯体の代表的構造の一つである。図1-aによく用いられる正八面体形構造の簡略式を示す。正三方柱形は[Re{S2C2(C6H5)2}3]について1965年に発見された(図1-b)。五方錐形の例としては[Sb(OX)3]3⁻がある。配位数7の場合は,[ZrF7]3⁻(図1-c),[UF5O2]3⁻のような五方両錐形,[TaF7]2⁻(図1-d),[NbF7]2⁻のような面冠三方柱形,[NbOF6]3⁻(図1-e)のような面冠八面体形がある。配位数8の場合には,対称性の高い構造が多く,実例もかなり多い。三角十二面体形[Mo(CN)8]4⁻(図1-f),正方ねじれ柱形(アルキメデスの逆プリズム)[TaF8]3⁻(図1-g),六方両錐形[UO2(NO3)2(H2O)2](図1-h),立方体形[UF8]3⁻(図1-i)。配位数9の場合には,[Nd(H2O)9]3⁺(図1-j),[ReH9]3⁻のような三面冠三方柱形,[UBr7O2]5⁻のような七方両錐形があり,面冠正方ねじれ柱形もある。配位数10の例としては[Ce(NO3)5]2⁻,配位数11の例としては[Th(NO3)4(H2O)3](結晶中)などがあるが構造は複雑である。配位数12の例としては正二十面体形の[Ce(NO3)6]3⁻がある(図1-k)。
配位子の例であげたNO2とONO,SCNとNCSなどのように,同じ原子団が異なる原子で配位し,他の配位子は同じであるとき,この二つの錯体は結合異性あるいは連結異性の関係にあるという(古くは塩異性と呼ばれていた)。その他多数の異性現象があるが,最も重要なのは幾何異性と光学異性で,歴史的にも意義が深い。ウェルナーは27組の[Ma4b2],[M(AA)2b2],[M(AA)2bc],[Ma3b3](a,b,cは単座配位子,AAは二座配位子をあらわす)型錯体について,幾何異性体がそれぞれ2種類ずつしか存在しないことを実験的に証明して,六配位錯体が正八面体形構造をもつという配位説が正しいことを明らかにした(正三方柱形と平面六角形では3種類になるはずである)。現在でも新しい錯体を合成した場合に,セファデックスカラムクロマトグラフィーなどにより異性体を分離することは構造を推定する重要な手段の一つになっている。図2-aに[Ma4b2],図2-bに[Ma3b3]の場合の幾何異性体の構造を示す。後者の場合の記号fac(facialの略),mer(meridionalの略)は比較的最近使われるようになったもので,以前はシス-シスcis-cis,シス-トランスcis-transと呼ばれていたものである。[M(AA)2bc],[M(AA)2b2]錯体のシス異性体は回反軸をもたない(キラリティーの条件)ので光学異性体を生ずる。例として[CoCl(NH3)(en)2]2⁺の幾何異性体と光学異性体を図2-cに示す。光学異性体の絶対配置は[Co(en)3]3⁺について日本で初めてX線によって決定された(斉藤喜彦ら,1955)。
遷移金属錯体の多様な色は,おもに可視部にある結晶場,配位子場,あるいはd-d吸収帯と呼ばれる吸収帯によることが多い。あまり強くない(logε<3)この吸収帯は配位子場によって分裂したdε,dγ両軌道間の禁制遷移によるもので,CoⅢ,CrⅢ錯体では二つあり,長波長から第一,第二吸収帯と名づけられた(柴田雄次,1915)。槌田竜太郎(1938)はこれらが配位子の次の順序に従って長波長に移動することを発見し,この順序を分光化学系列と名づけたが,これは配位子場理論が金属錯体に適用されるはるか前のことであった。新村陽一,槌田(1956)はさらに詳しい系列を発表している。
(短波長)CN⁻,NO2⁻,en,NH3,ONO⁻,H2O,NCS⁻,SO42⁻,NO3⁻,OH⁻,OX3⁻,CO32⁻,S2O32⁻,Cl⁻,CrO42⁻,Br⁻(長波長)。
分光化学系列は配位子場の強さを示すものであるが,錯体の熱力学的安定度とも密接な関係があり,一般に上位にある配位子ほど金属と強く結合する。このことは錯体を合成するときにも利用することができる。なおこの系列は配位原子についてみると,C>N>O,S>F>Cl>Br>Iの順である。低対称正八面体形錯体の配位子場吸収帯の分裂は角関数重なりモデルによる計算(山寺秀雄,1958)によってよく説明できる。錯体には主として紫外部に強い(logε=3~4)吸収帯をもつものが多い。これは配位子自身の吸収帯である場合以外はほとんどが配位子→金属,あるいは金属→配位子間の許容遷移による吸収帯で,電荷移動吸収帯(CT吸収帯)と呼ばれ,可視部にあらわれる場合には,その金属についての感度のよい比色分析が可能となる。錯体中の金属と配位原子間の結合はイオン結合と共有結合の中間と考えられる。[Co(NH3)6]3⁺を例にとると,完全なイオン結合であればCoの酸化数は3であり,完全な共有結合ならばCoの形式電荷は-3となるはずである。L.C.ポーリングは一般に安定な化合物中の各原子に存在する実際の電荷はごく小さいものであり,錯体中の中心金属の電荷が0に近いという〈電気的中性の原則〉を提唱したが,多くの実験結果はこれがほぼ正しいことを裏書きしている(上の例では精密X線回折の結果は+0.7)。分子軌道法の立場からは強い配位子場は強い共有結合を意味するので,分光化学系列は共有結合性の順序を示す一つの尺度である。他の面からみた共有結合性の尺度として,吸収帯の解析から得られる電子雲膨張(あるいは拡大)系列がある(シェファーC.E.Schäffer,ヨルゲンセンC.K.Jørgensen,1958)。配位子の赤外吸収スペクトルは配位子が金属と結合することにより変化する(吸収帯の位置,強度の変化および分裂)ので,錯体の構造に関して重要な情報を提供する。その他多数の新しい分光学的手段が用いられている。錯体の磁性も構造決定に有用である。
正八面体形dn錯体(nはd電子の数)において分裂したdε軌道とdγ軌道へ電子が入るとき,d4~d7イオンでは2種類の錯体ができる。一つは分裂した準位間のエネルギー差が大きいときで,電子は対をつくってエネルギーの低いdε軌道に入る。これを低スピン錯体(スピン対型錯体)という。分裂エネルギー差が大きくない場合には,エネルギーの高いほうのdγ軌道に入っても対をつくらないほうが全体としてエネルギーが低くなる。これを高スピン錯体(スピン自由型錯体)という。錯体中の配位子が水溶液中で水あるいは他の配位子により置換される反応の速度は,個々の配位子の種類にはあまり関係がなく,錯体の電子状態によりほぼ決まってしまうことがタウベH.Taube(1952)により指摘された。CoⅢ,PtⅡ錯体のように置換の遅いものを置換不活性錯体,CuⅡ,NiⅡ錯体のように置換が一瞬のうちに起こるものを置換活性錯体という。前者はおもに低スピン錯体およびd3錯体であり,後者はその他の電子状態の錯体である。置換活性錯体の関連する化学平衡は速やかに成立するので,化学平衡の移動に関する多くの研究が安定度定数の測定によりなされている。安定度を支配するおもな因子としては中心イオンの種類,配位子の塩基性,キレート効果等があり,安定度の考察から,硬い(ハード)酸は硬い塩基と,軟らかい(ソフト)酸は軟らかい塩基と結合しやすいというHSAB則が発展した。
六配位錯体の水溶液中における置換反応は,配位水と他の配位子の入替りという形で進み,水以外の配位子どうしが直接置換することはほとんどないことがわかっている。平面正方形錯体では,ある配位座にある配位子の置換速度はそれに対してトランス位にある配位子により支配されること(トランス効果)が古くから知られており,錯体の合成や構造決定に利用されている。電子移動反応(酸化還元反応)の機構としては,二つの金属イオンを結ぶ架橋配位子が生じ,それを通って電子が流れる内圏反応機構と,内部配位子に変化がなく,直接電子が流れる外圏反応機構とがある。配位子は配位により単独のときと異なった反応を受けたり,錯体中で移動したりするが,これらはウィルキンソンWilkinson錯体[RhCl{P(C6H5)3}3]のような錯体触媒において重要な役割を演じている。
執筆者:近藤 幸夫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
一つの原子あるいはイオン(普通は金属イオン)を中心として、その周りにいくつかの他の原子、イオン、分子あるいは原子団(これらを配位子という)が、方向性をもって立体的に配位し、一つの原子集団をつくっているとき、これを錯体といっている。化学式では[ ]でくくり、錯体であることを示す。また錯体がイオンである場合、錯イオンという。錯体を含む化合物を一般に錯化合物といい、分子化合物と区別するために用いられる。
配位子と中心原子との間の化学結合は、イオン結合性、共有結合性いずれでもよく、多くの場合、その両者の中間を示し、両方の要素をもっている。このことは多くの化合物にみられ、たとえば硫酸イオンSO42-、クロム酸イオンCrO42-などでは、それぞれ中心原子S6+、Cr6+の周りに、四つのO2-が正四面体をつくるように配位した錯体であり、また、ミョウバンKAl(SO4)2・12H2Oの結晶中にみられる[Al(H2O)6]3+や、黄血塩のK4[Fe(CN)6]・3H2O中の[Fe(CN)6]4-あるいは[Co(NO2)3(NH3)3]のような分子は、それぞれAl3+、Fe2+、Co3+などを中心原子として、H2O、(CN)-、NO2-、NH3などの配位子が八面体型に配位してできた錯体(錯イオン)である。ただし以上の例で、硫酸イオンのような場合には、中心原子が非金属元素であるため、普通は錯体といわないことが多い。その意味で中心原子が金属原子の場合には金属錯体ということもある。
多くの金属塩類は錯体を含むのが普通で、水溶液中では錯イオンとして存在することが多い。たとえば、硫酸銅(Ⅱ)の水溶液中では[Cu(H2O)6]2+が存在する。
[中原勝儼]
錯体のうち、中心原子が二つある場合を二核錯体あるいは複核錯体、二つ以上ある場合を多核錯体といっている。たとえば、酢酸銅(Ⅱ)一水和物は普通Cu(CH3COO)2・H2Oのように書かれるが、実はのような複核錯体[Cu2(CH3COO)4(H2O)2]であり、同じく塩基性酢酸クロム(Ⅲ)Cr3(CH3COO)7(OH)2・2H2Oは[Cr3O(CH3COO)6(H2O)3](CH3COO)であって、3個のクロム原子が正三角形をつくり、その中心に酸素原子が位置し、三角形の各辺に沿って二つのCH3COOが橋架けし、それぞれのクロム原子にH2O分子が一つずつ配位した八面体型6配位の三核錯体である。同様に塩基性酢酸ベリリウムBe4O(CH3COO)6といわれているものは、のように四つのベリリウム原子がほとんど四面体をつくり、中心に酸素原子が位置し、六つの稜(りょう)を六つのCH3COO-が橋架けしてできた四核錯体である。また水酸化アルミニウムAl(OH)3は、のように八面体型6配位の[Al(OH)6]3-がOH-を橋架けとして無限に連なった無限多核錯体(通常、巨大分子といっている)であるといえる。このような例はきわめて多く、遷移金属の塩類はほとんどがこの種の単核錯体ないし多核錯体を含むものである。
配位子がキレート配位子である場合、すなわち、一つの中心原子に一つの配位子が二つ以上の配位原子で配位するときは、できた錯体をキレート錯体という。
[中原勝儼]
『渡部正利・矢野重信・碇屋隆雄著『錯体化学の基礎――ウェルナー錯体と有機金属錯体』(1989・講談社)』▽『錯体化学研究会編『分子を超えて――錯体の世界』(1991・化学同人)』▽『山崎一雄・吉川雄三・池田龍一・中村大雄著『錯体化学』改訂第2版(1993・裳華房)』▽『中原勝儼著『無機化合物・錯体辞典』(1997・講談社)』▽『岩本振武・荻野博・久司佳彦・山内脩編『大学院錯体化学』(2000・講談社)』▽『基礎錯体工学研究会編『新版 錯体化学――基礎と最新の展開』(2002・講談社)』▽『渡部正利・山崎昶・河野博之著『錯体のはなし』(2004・米田出版、産業図書発売)』
【Ⅰ】中心の原子,あるいはイオン(普通は金属イオン)のまわりに,特定数の原子,分子,イオン(これを配位子という)が結合している化合物をいう.たとえば,[Cr(CO)6],[Cr(CN)6]3- など.ただし,典型的なイオン結合,金属結合の化合物は除かれる.錯塩(酸,塩基を含む),錯分子がこれに属する.また,中心が遷移金属イオンの錯塩を,とくに金属錯塩ということもある.錯体はまた,ウェルナー錯体,非ウェルナー錯体に分類される.中心の原子またはイオンの数によって,一核(単核)錯体,二核(複核)錯体などといい,二核以上を多核錯体という.【Ⅱ】錯体を配位化合物と同じ意味で用いることがあるが,このときは分子化合物や付加物まで含まれる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
出典 株式会社平凡社百科事典マイペディアについて 情報
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
血液中の脂質(トリグリセリド、コレステロールなど)濃度が基準値の範囲内にない状態(脂質異常症)に対し用いられる薬剤。スタチン(HMG-CoA還元酵素阻害薬)、PCSK9阻害薬、MTP阻害薬、レジン(陰...
4/12 日本大百科全書(ニッポニカ)を更新
4/12 デジタル大辞泉を更新
4/12 デジタル大辞泉プラスを更新
3/11 日本大百科全書(ニッポニカ)を更新
2/13 日本大百科全書(ニッポニカ)を更新