精選版 日本国語大辞典 「クロム」の意味・読み・例文・類語
クロム
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
翻訳|chromium
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
周期表第6族に属する金属元素の一つ。原子番号24、元素記号Cr。1797年フランスのボークランがシベリア産の鉱物である紅鉛(こうえん)鉱PbCrO4から発見した。クロムの化合物には鮮やかな色を示すものが多いことから、ギリシア語で「色」を意味するchromaにちなんで命名された。単体は三酸化二クロムCr2O3の炭素還元によって得られたが、これは微量の炭素を含んでおり、無炭素の純金属はアルミニウム還元によって得られた。19世紀初めから革なめしや顔料などの用途が開発されたが、製鋼に利用されたのは1910年以降である。
[岩本振武]
主要鉱石はクロム鉄鉱(主成分FeCr2O4)であり、南アフリカ、ロシアなどに産出する。鉱石を炭酸アルカリと融解し、空気を吹き込んでクロムを6価に酸化し、水で抽出して酸性とすると、二クロム酸塩を得る。これを硫黄(いおう)あるいは炭素で還元し、酸化クロム(Ⅲ)とする。酸化クロム(Ⅲ)はクロム化合物製造の原料としても用いられる。酸化クロム(Ⅲ)をケイ素、アルミニウム、マグネシウムなどで加熱還元すると、体心立方構造のα(アルファ)型クロムが得られ、クロム(Ⅲ)塩水溶液を電解すると、六方晶系のβ(ベータ)型クロムを得る。β型はα型より高純度である。さらに純度の高いクロムは、β型の電解クロムを塩素気流中で500~600℃に加熱して生じた塩化クロム(Ⅲ)を水素で還元すると得られる。銀白色の光沢を示す金属。体心立方構造のα型は格子定数a=2.88Å、六方構造のβ型はa=2.72、c=4.42Åである。β型は準安定相で、800℃でα型に転移する。
[岩本振武]
常温ではきわめて安定で、空気や水には侵されない。塩酸や希硫酸には水素を発生して溶け、クロム(Ⅱ)塩の溶液となるが、空気中の酸素によって迅速にクロム(Ⅲ)に酸化され、溶液の色は青から緑に変わる。硝酸、クロム酸、リン酸、塩素酸、過塩素酸、王水などの酸化性の酸に浸すと、金属の表面に酸化物の強固な薄膜層を生じ、不動態(不働態)となって溶解しない。クロムおよびクロム合金が耐食性であるのは、この事実に基づくものと考えられている。濃硫酸には二酸化硫黄を発生しながら溶け、クロム(Ⅲ)塩の溶液となる。
高温度では塩素、硫黄、酸素、炭素、窒素などと反応して、それぞれ三塩化クロムCrCl3、三硫化二クロムCr2S3、三酸化二クロムCr2O3、二炭化三クロムCr3C2、窒化クロムCrNとなる。
クロムに通常みられる酸化数は+Ⅲおよび+Ⅵであり、+Ⅱの状態は不安定で、容易に+Ⅲの状態へ酸化される。この性質を利用して、クロム(Ⅱ)塩の溶液は酸素吸収剤として用いられる。酸化物としては、これらの酸化数のもののほか、二塩化二酸化クロムCrCl2O2(塩化クロミルCrO2Cl2)の蒸気を熱分解して得られる三酸化クロムCrO3がある。二価金属とクロム(Ⅲ)との複酸化物M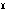 Cr2O4(M
Cr2O4(M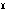 はバリウム、銅など)は亜クロム酸塩とよばれることもあるが、それは誤りで、スピネル型構造をとり、CrO2-あるいはCr2O42-のようなイオンは存在しない。クロム(Ⅲ)の無水のハロゲン化物は、フッ化物がイオン結合性であるほかは、共有結合性であると考えられている。しかし、水和物では、水および塩化物イオンが配位子となった錯イオンの塩となる。たとえば、塩化クロム(Ⅲ)六水和物には3種類あることが知られており、それぞれの結晶の色も異なっている。
はバリウム、銅など)は亜クロム酸塩とよばれることもあるが、それは誤りで、スピネル型構造をとり、CrO2-あるいはCr2O42-のようなイオンは存在しない。クロム(Ⅲ)の無水のハロゲン化物は、フッ化物がイオン結合性であるほかは、共有結合性であると考えられている。しかし、水和物では、水および塩化物イオンが配位子となった錯イオンの塩となる。たとえば、塩化クロム(Ⅲ)六水和物には3種類あることが知られており、それぞれの結晶の色も異なっている。
[CrCl2(H2O)4]Cl・2H2O 深緑
[CrCl(H2O)5]Cl2・H2O 青緑
[Cr(H2O)6]Cl3 紫
これらは水和の程度が異なる異性体であり、この異性現象を水和異性という。この例のほかにも、クロム(Ⅲ)の錯イオンには、配位子によってさまざまな色を呈するものが知られている。
クロム(Ⅵ)はイオンポテンシャルが大きく、つねに電気陰性度の大きい元素の原子と結合した状態で存在する。クロム酸イオンは正四面体型構造をとり、その塩の多くは難溶性である。二クロム酸塩は酸性溶液中で強力な酸化剤となる。酸化数0のクロムの化合物としてはヘキサカルボニルクロム[Cr(CO)6]があり、カルボニルをピリジンなどのアミンで置換した誘導体などが知られている。
[岩本振武]
クロム含量が50~70%、残りが鉄ならびに数%以下の炭素およびケイ素を含む合金をフェロクロム(フェロアロイ)とよび、クロム鉄鉱の直接還元によって製造される。これをクロム源として鋼に添加して精錬されたクロム合金鋼は、耐食性および機械的に優れた性質を示し、クロム含量が12%以上のものをステンレス鋼とよぶ。クロムとニッケルの合金には耐熱性に優れたものがあり、また酸化クロム(Ⅲ)を添加した耐火れんがは、電気炉や転炉の壁材に用いられる。クロムめっきは耐食性と装飾性に優れるだけでなく、摩擦係数も小さい。
[岩本振武]
金属クロムあるいはクロム(Ⅲ)化合物には毒性はないが、クロム(Ⅵ)化合物は刺激性があり、腐食作用が強く、危険であることが多い。一般に「六価クロム」とよばれるものは、このクロム(Ⅵ)化合物のことである。たとえば、クロム酸カリウムK2CrO4や二クロム酸カリウムK2Cr2O7などの微粉を吸い込むと鼻の粘膜が冒され、呼吸系統を傷める。空気中での最大許容量は1日8時間の暴露で、1立方メートル中0.1ミリグラムCrO3とされる。
[岩本振武]
周期表第VIA族に属する元素の一つ。1797年フランスのN.L.ボークランがシベリア産紅鉛鉱(主成分PbCrO4)中から発見し,その化合物の美しい色からギリシア語のchrōma(色)にちなんで命名した。1854年ドイツのR.W.ブンゼンは塩化クロム(Ⅱ)CrCl2水溶液の電解ではじめて少量の金属単体を分離し,99年ドイツのゴルトシュミットHans Goldschmidtがテルミット法によって比較的純粋な金属クロムを得ることに成功した。地球上には広く分布しているが,存在量はあまり多くない。天然に遊離状態では存在しない。主要鉱石は,クロム鉄鉱,紅鉛鉱。主産地は,ロシアのウラル地方,南アフリカ,ギリシア,トルコ,フィリピンなど。宝石のルビーの赤色,エメラルドの緑色は,微量のクロムの存在がその原因となっている。
単体は,銀白色,光沢のある硬くてもろい金属。α型(体心立方格子,格子定数a=2.8796Å。テルミット法でつくられる)とβ型(六方最密格子,格子定数a=2.72Å,c=4.42Å。電解法でつくられる)があるが,β型は準安定で,800℃でα型になる。強磁性。常温ではきわめて安定で,空気または水に侵されない。強熱すれば,ハロゲン,硫黄,窒素,炭素,ケイ素,ホウ素などと直接反応する。塩酸,硫酸などには溶け,2価クロム塩の水溶液となって青色を呈するが,直ちに空気で酸化されて3価クロムになり緑色を呈する。しかし濃硝酸,王水などの酸化力のある酸では金属表面が酸化され,不働態を生じて溶けない。また空気中に長時間放置すると塩酸などにも溶けにくくなる。酸化数Ⅲの場合,単塩としては鉄,アルミニウムとよく似た化合物をつくり,またコバルトと同型の錯塩をつくる。なお,二クロム酸ナトリウムNa2Cr2O7など6価クロムを含む化合物は有毒であるので注意を要する。
クロムは,融点が高く,耐酸化性が大きいことなどのほか,ニッケル,コバルトと比べると資源的に豊富であるため,クロムめっき,合金鋼(特殊鋼),非鉄金属などとして広く用いられる。クロム鋼,ニッケル・クロム鋼,クロム・モリブデン鋼などの合金鋼として用いられる量が多く,また,ニッケル-クロム-チタン合金,コバルト-クロム合金などとして,耐熱性を要求される部品材料としての金属クロムの用途も増しつつある。
鉄鋼用にはフェロクロム(フェロアロイ)として生産される。フェロクロムは,クロム鉄鉱FeO・Cr2O3をコークスとともに電解炉で還元して得る。これには炭素C,ケイ素Siが多いため,目的によっては,さらに精製して低炭素フェロクロム(C<0.1%,Si<1~5%,Cr=65~70%,Fe=残部)とする。金属クロムは乾式法,湿式法で製造される。乾式法では,微粉砕したクロム鉄鉱を炭酸ナトリウムとともに酸化焙焼してクロム酸ナトリウムNa2CrO4とし,これを水で抽出したのち再び分解して得られる酸化クロム(Ⅲ)Cr2O3をアルミニウムまたはケイ素で還元する。得られる金属クロムの純度は99%程度で,アルミニウム,ケイ素を0.8%程度含む。湿式法では,クロム鉄鉱を硫酸で処理し,抽出液を精製したあと隔膜電解により,陰極のステンレス鋼の上に金属クロムを析出させる。電解液にはCr2(SO4)365g/l,CrSO465g/l,(NH4)2SO4350g/lの組成のものが使用される。さらに高純度のクロムは,この電解クロムを炭素とともに塩素ガス中で加熱して,塩化クロム(Ⅲ)CrCl3とし,これを水素で還元してつくることもある。
執筆者:中原 勝儼+後藤 佐吉
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Cr.原子番号24の元素.電子配置[Ar]3d54s1の周期表6族遷移金属元素.原子量51.9961(6).天然には,質量数50(4.345(13)%),52(83.789(18)%),53(9.501(17)%),54(2.365(7)%)の安定核種が存在し,ほかに質量数42~67までの放射性同位体がある.1797年,フランスのN-L. Vauquelinが,紅鉛鉱PbCrO4から新元素を発見し,翌年炭素による酸化物の還元により金属を得た.元素名は,得られる塩類が各種の色彩をもつことから,ギリシア語の“色”χρωμα(chr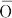 ma)にちなんで命名された.
ma)にちなんで命名された.
遊離の状態では産出せず,主要鉱石はクロム鉄鉱Cr2FeO4や紅鉛鉱PbCrO4である.また,ルビー,エメラルドの着色原因となって,これらの宝石中に微量存在している.地殻中の存在度185 ppm.世界の埋蔵量の95% がカザフスタンと南アフリカに偏在し,ついでインドの順である.産業にとって不可欠で重要な原材料であるレアメタルとして,Ni,Mn,Moなどとともに,1983年から実施している国家備蓄対象鉱種の一つ.わが国は,ほぼ全需要量を中間製品であるフェロクロムの形で,南アフリカから50%,カザフスタンから27% 輸入した(2005年).クロム鉄鉱を電気炉中で,融剤とともに溶融してコークスなどで還元してクロム含量約60% のフェロクロムが得られる.金属は,アルミニウム-テルミット法による酸化クロム(Ⅲ)Cr2O3の還元や,アンモニウムクロムミョウバンなど CrⅢ水溶液の電解によって得られる.銀白色の体心立方格子金属で,融点1860 ℃,沸点2671 ℃.密度7.19 g cm-3.第一イオン化エネルギー6.766 eV.標準電極電位 Cr2+/Cr-0.90 V,Cr3+/Cr2+-0.424 V.原子半径0.125 nm.塩酸,硫酸には二価の化合物として溶解し,酸化力の強い硝酸や王水には,不動態となって不溶.常温ではきわめて安定で,空気中では侵されず,ハロゲン,硫黄,酸素などの非金属元素とは高温で直接反応する.酸化数は-2~6であるが,通常は2,3,6.二価のクロムは空気中の酸素により容易に酸化され三価になるので除酸素剤としての応用がある([別用語参照]クロム化合物).もっとも安定な酸化数は3で,多くの六配位八面体錯塩をつくる.六価のクロムは強い酸化剤である.クロムは,不動態をつくりやすいため耐食性に富み,めっきとしての用途は,きわめて広い.光沢,硬さ,耐摩耗性にもすぐれている.添加すると強度,耐食性,高温耐熱性が向上するため,合金成分として多用される.用途の約95% はステンレス鋼,耐熱鋼など特殊鋼用でフェロクロムまたはクロム鉱石の形で製鋼の際に添加される.Ni,Co,Moなどとのスーパーアロイ製造には金属クロムが使われ,原子炉材料,ジェットエンジン・タービンブレード,化学プラント・反応塔,磁性材料などに用いられる.ニクロムは,ニッケルとの合金で,電気抵抗が大きく,電熱器用としてよく知られている.クロムはインスリンのはたらきを増強する重要な栄養素であるが,金属クロムはPRTR法・第一種指定・経口クラス3(水質基準値0.1 mg L-1 以下),作業環境クラス3(10 mg m-3 以下(気体)),感作性クラス1.[CAS 7440-47-3]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
出典 株式会社平凡社百科事典マイペディアについて 情報
(斎藤幾郎 ライター / 2009年)
出典 (株)朝日新聞出版発行「知恵蔵」知恵蔵について 情報
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
中国のゴビ砂漠などの砂がジェット気流に乗って日本へ飛来したとみられる黄色の砂。西日本に多く,九州西岸では年間 10日ぐらい,東岸では2日ぐらい降る。大陸砂漠の砂嵐の盛んな春に多いが,まれに冬にも起る。...
4/12 日本大百科全書(ニッポニカ)を更新
4/12 デジタル大辞泉を更新
4/12 デジタル大辞泉プラスを更新
3/11 日本大百科全書(ニッポニカ)を更新
2/13 日本大百科全書(ニッポニカ)を更新