翻訳|myosin
精選版 日本国語大辞典 「ミオシン」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「ミオシン」の意味・わかりやすい解説
ミオシン
みおしん
myosin
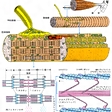
筋肉を構成するタンパク質の一つで、1942年セント・ジェルジーによって単離された。アクチンとともに、筋原線維(筋線維内に多数縦走する円筒状の微細構造)の主要な構成要素で、ウサギの骨格筋では筋原線維タンパク質の50%前後を占める。サルコメア(筋原線維中の線維方向にみられる繰り返しの単位)の太いA-フィラメント(長線維)は200~400個のミオシン分子からなり、濃い中性塩溶液に溶け、水で薄めると沈殿する。このとき、ミオシンが重合して幅15ナノメートル(1ナノメートルは10億分の1メートル)、長さ300~2000ナノメートルのフィラメントができる。ミオシンの分子量は約48万で、分子量約22万のH鎖2本と分子量2万前後のL鎖4本に分けられる。分子の形は頭が二つあるマッチ棒のようで、頭はすこし傾き、軸はなかばで折れ曲がっている。長さ160ナノメートル、直径2ナノメートルとされている。温和な条件でトリプシン処理すると、ATP加水分解酵素(ATPアーゼ)活性とアクチン結合能をもつ頭の部分(H=ヘビー-メロミオシンといい、分子量約36万、水溶性)と、ミオシンに会合性および水不溶性をもたらしている軸の部分(L=ライト-メロミオシンといい、分子量約10万)とに切断される。H-メロミオシンはさらに10~11万のS-1と約6万のS-2に分解される。S-1はミオシンの二つの頭の一つに相当し、アクチンとの結合部位、ATPアーゼ活性中心をもつ。
筋肉の収縮は、A-フィラメントをつくる多くのミオシンの頭がアクチンからなる細いⅠ-フィラメントを手繰り寄せ、A-フィラメントの中央へ滑り込ませることによって生じると考えられている。ATPアーゼ活性はアクチンが共存するときに高くなる。なお、ミオシンは筋肉に限らず、ほかの多くの細胞内にも存在しており、非筋ミオシンとよばれている。
[野村晃司]
『科学編集部編『生物科学の新しい展開――分子から細胞へ』(1987・岩波書店)』▽『上代淑人・矢原一郎編『細胞増殖・細胞運動』(1989・丸善)』▽『新井健一編『水産動物筋肉タンパク質の比較生化学』(1989・恒星社厚生閣)』▽『日本生化学会編『新・生化学実験講座1 タンパク質(3) 高次構造』(1990・東京化学同人)』▽『神谷律・丸山工作著『細胞の運動』(1992・培風館)』▽『James Darnell他著、野田春彦他訳『分子細胞生物学』下(1993・東京化学同人)』▽『日本水産学会監修、西田清義編『魚貝類筋肉タンパク質――その構造と機能』(1999・恒星社厚生閣)』▽『大野秀樹他編『Q&A 運動と遺伝』(2001・大修館書店)』▽『日本水産学会監修、関伸夫他編『かまぼこの足形成――魚介肉構成タンパク質と酵素の役割』(2001・恒星社厚生閣)』
化学辞典 第2版 「ミオシン」の解説
ミオシン
ミオシン
myosin
筋収縮に関与する筋肉細胞内の筋原繊維を構成する分子量4.8×105,長さ約150 nm の巨大構造タンパク質で,分子量2.2×105 のH鎖2本と分子量1.5×104 のL鎖4本からなる.アデノシン5′-三リン酸(ATP)の高エネルギーリン酸結合の加水分解反応を触媒するATPアーゼでもある.すりつぶした筋肉から抽出したミオシン溶液を0.6 mol L-1KCl溶液での溶解と希釈による沈殿操作を繰り返すことによって精製できる.2本の長いαヘリックス鎖の一端が非対称な二つの球状になっている分子で,トリプシン処理により鎖の中心付近で特異的にペプチド結合が切断されて,L-メロミオシン(light meromyosin)と二つの球状タンパク質を含むH-メロミオシン(heavy meromyosin)の2成分に分解される.ATPアーゼの触媒活性部位がミオシン1分子当たり二つあるが,これらの活性部位は二つの球状タンパク質にそれぞれ存在している.ATPアーゼ活性を阻害しているSH基と触媒活性に必要なSH基の2種類のSH基があるが,これらのSH基も二つの球状タンパク質にそれぞれ存在し,しかもこれらのSH基がアクチンとの結合にも深く関与している.ミオシンATPアーゼは Ca2+ により活性化され,pH 6.0と pH 9.5に至適 pH がある.しかし,アクチンと結合すると性質の異なるアクトミオシン型ATPアーゼにかわる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
改訂新版 世界大百科事典 「ミオシン」の意味・わかりやすい解説
ミオシン
myosin
筋肉を構成するタンパク質の一つ。筋繊維に含まれる筋原繊維を構成するタンパク質の約60%がミオシンであり,脊椎動物の骨格筋では長さ約1.5μ,太さ約150Åのミオシンフィラメント(これをAフィラメントという)を形成している。ミオシンは分子量約50万で,長さ約1500Åの棒状の部分と2個の頭部からなり,適当な条件下で自動的に集合してミオシンフィラメントを形成する性質がある。このとき,棒状の部分はフィラメントの軸を形成し,頭部は外に突き出して架橋となる。架橋はミオシンフィラメントにそって143Åおきに120度ずつずれて突出しており,それぞれミオシンフィラメントのまわりのアクチンフィラメント(これをIフィラメントという)と向き合っている。ミオシン分子の頭部はATPアーゼ活性をもち,筋肉の収縮はミオシンフィラメントの架橋がATPを分解しながらアクチンフィラメントと反応することによりおこると考えられる。
→アクチン →筋収縮
執筆者:杉 晴夫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「ミオシン」の意味・わかりやすい解説
ミオシン
→関連項目グロブリン
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「ミオシン」の意味・わかりやすい解説
ミオシン
myosin
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「ミオシン」の解説
ミオシン
世界大百科事典(旧版)内のミオシンの言及
【ATPアーゼ】より
…すなわち生体は,常になんらかの物理的仕事に対するエネルギーの供給と共役したかたちでATPを分解するように造られており,ATPがむだに加水分解されることはない。たとえば筋肉の収縮タンパク質であるミオシンは機械的仕事と共役したATPアーゼの一つであり,反応過程におけるそれ自身の高次構造変化やアクチンとの相互作用などを通じて,ATPのエネルギーを筋収縮の仕事に変換する機能をもっている。一方,筋小胞体と呼ばれる筋肉の細胞器官の膜に大量に存在する別種のATPアーゼは,ATPの分解に先立って細胞質中のCa2+イオンを強く結合し,小胞体内のCa2+濃度が細胞質より高い場合でも,ATPの分解とともにそれを膜の内腔に輸送する性質を示す。…
【筋収縮】より
…平滑筋の収縮は交感神経と副交感神経によって調節されており,一方が収縮を他方が弛緩をおこすが,そのしくみには不明な点が多い。
[脱分極と収縮との関係]
筋収縮は,筋フィラメントを形成するタンパク質アクチンとミオシン間の反応によるものであり,このエネルギー源はATPである(図2)。静止状態の筋肉では,アクチンとミオシン間の反応がトロポミオシンおよびトロポニンというタンパク質によって抑制されているので収縮はおこらない。…
※「ミオシン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
ローマ法王ともいう。ラテン語 Papaの称号はカトリック教会首長としてのローマ司教 (教皇) 以外の司教らにも適用されていたが,1073年以後教皇専用となった。使徒ペテロの後継者としてキリスト自身の定...