翻訳|phosphorus
精選版 日本国語大辞典 「リン」の意味・読み・例文・類語
りん
- 〘 副詞 〙 ( 多く「と」を伴って用いる )
- ① 金属などが物に当たって発する音を表わす語。
- [初出の実例]「鏗爾と云は、瑟を下にをくときに、りんとなるを云也」(出典:足利本論語抄(16C)先進第十一)
- ② 鈴やベルなどの鳴る音を表わす語。
- ③ 口三味線で、三の糸をばちですくった音を表わす語。
日本大百科全書(ニッポニカ) 「リン」の意味・わかりやすい解説
リン(元素)
りん
phosphorus
周期表第15族に属し、非金属元素の一つ。古くヨーロッパでは暗闇で光るものをphos(光)、phoros(運ぶもの)とよんでいたし、中国や日本でも陰火、鬼火などを燐(りん)とよんでいた。たとえばBolognian phosphorosとよばれたものは、イタリアのボローニャ地方で発見された重晶石を熱してつくった不純物を含む硫化バリウムで、暗中で発光するリン光体であった。これらはphosphorusとよばれていた。1669年ドイツのハンブルクの商人で錬金術師のブラントHenning Brand(1630―1710)は、人間の尿を蒸発濃縮し、空気を遮断して強熱し、白色ワックス状の物質を得た。これが現在リンといっているものの初めてのものであるといえよう。そしてこのものが暗闇で光を発することが知られ多くの人に興味をもたれた。ドイツのクンケルJ. Kunckel(1630―1702)は1678年、尿に砂を混ぜて熱することにより、よりよくつくれることをみいだした。1771年スウェーデンのシェーレは骨灰からリンを取り出すことに成功し、18世紀の終わりごろには、フランスのラボアジエが、リンが元素であることを示した。
[守永健一・中原勝儼]
存在
天然には単体として存在せず、酸素と化合したリン酸の誘導体としてみいだされる。おもな鉱物は燐(りん)灰石Ca5F(PO4)3であり、鳥の糞(ふん)が堆積してできるグアノ質リン鉱石もある。動物の骨や歯はおもにリン酸カルシウムであり、生物体には複雑な有機リン化合物(核酸など)として含まれ、生命に重要な役割をもっている。
[守永健一・中原勝儼]
製法
昔は骨灰を硫酸で処理してリン酸をつくり、木炭などと乾留してつくった。現在、工業的には燐鉱石に珪石(けいせき)とコークスを加え、電気炉中で1400~1500℃に強熱し、発生するリン蒸気を水中に導いて凝縮させると、
4Ca5(PO4)3+18SiO2+30C
―→18CaSiO3+9CaF2+30CO+3P4
のようにして黄リンが得られる。
[守永健一・中原勝儼]
リンの同素体
リンには10種以上の同素体が報告されているが、基本的には白(黄)リン、紫リンおよび黒リンである()。リンを蒸留すると正四面体のP4分子として蒸発し、これを冷却すると白リンが得られる。白リンは蒸留したばかりでは無色であるが、しばらくすると表面が黄色になる。このため白リンは黄リンともよばれる。黄(白)リンは無色~黄色のろう状固体。純粋なものは無色で、市販品(99.9%純度)がわずかに黄色なのは、表面に赤リンの膜を生じたからであるといわれるが確かではない。黄リンは液体でも固体でもP4分子からなる。800℃以下の蒸気はP4分子からなり、これを超えるとP2への解離がおこる。赤リンは白リンと紫リンの固溶体であると考えられており、空気を絶って黄リンを400℃に数時間加熱してつくる。赤リンには6種類の変態が知られる。市販品は無定形であるが、結晶性のものに紫(し)リンがある。黒リンは黄リンを非常に高い圧力下に熱するか、水銀を触媒に黒リンの小結晶を加えて220~370℃に8日間黄リンの蒸気を熱してつくられる。黒リンは層状構造で、熱・電気を導く性質がある。
[守永健一・中原勝儼]
性質と用途
赤リンと黒リンは空気中で安定であるが、黄リンは空気中でリン光を発して酸化されるので水中に蓄える。発火点は、黄リンが約60℃、赤リンが230℃である。黄リンは二硫化炭素、ベンゼン、エーテルなどに溶けるが、赤リンと黒リンは水、二硫化炭素に溶けない。化学的反応性は黄リンがもっとも大きく、黒リンがもっとも小さい。黄リンはハロゲンと激しく反応するが、赤リンは熱しなければ反応しない。また、水酸化アルカリの濃溶液と熱するとき、黄リンはホスフィンPH3とホスフィン酸塩を生じて反応するが、赤リンは反応しない。赤リンも硫黄(いおう)と熱すれば硫化物をつくり、多くの金属と直接反応してリン化物をつくる。また黄リンと赤リンは濃硝酸によってリン酸を生じる。黄リンは猛毒である(経口致死量0.1グラム)。
黄リンはリン酸およびリン酸塩、赤リンなどの製造原料や殺鼠(さっそ)剤として、赤リンはマッチの製造、リン青銅などの製造、リンを含む医薬・農薬の合成などに用いられる。リン酸塩は合成洗剤、肥料としての用途が広い。
[守永健一・中原勝儼]
必須元素としてのリン
リンは地球上の全生物にとって水素、酸素、炭素、窒素、硫黄とともに必須元素である。人体中には平均0.63%(第11位)含まれている。人体では骨や歯は主成分がヒドロキシアパタイトCa5(PO4)3(OH)であり、デオキシリボ核酸(DNA)やリボ核酸(RNA)その他リン酸誘導体として、遺伝、光合成、代謝、神経、筋肉の作用など生体の重要な役割を果たしている。
[守永健一・中原勝儼]
人体とリン
リンは人体に約670グラム含まれ、無機質のなかでカルシウムの約1.2キログラムに次いで多い。とくに骨に多く、体内のリンの85%近くが骨の形成成分(リン酸カルシウム)として存在する。残りのリンは体全体に分布し、重要な生理作用をもっている。体液中のリンはリン酸イオンとして存在し、体液のpH調節に重要である。さらに細胞内では核タンパク質やリン脂質の構成成分であり、エネルギー代謝においてはATP(アデノシン三リン酸)としてエネルギーの産生に直接関係している。糖質、脂質の代謝にはリン酸塩が必要であり、各種の補酵素の構成成分でもある。ほとんどすべての食品に分布するが、とくに穀類、豆類に多い。食品からの摂取が容易なので欠乏や不足はみられない。摂取にあたってはカルシウムとのバランスがとれているほうが望ましく、一般にカルシウムとリンの比率はほぼ同量がよい。日本人の食生活では穀物の摂取が多いのでリンが多くとられている。穀物中のリンはフィチンという形で存在し、消化吸収が悪く、過剰摂取の問題は少ない。しかし、加工食品においては、pH調整用としてリン酸塩類が使用されたり、キレート化合物の性質をもち、品質改良剤として有用なポリリン酸塩なども使用されたりしている。したがって、加工食品を偏って食したときには、リンの過剰摂取が問題となり得る。食事からとるべき量については、「日本人の食事摂取基準」(厚生労働省)により、目安量、および過剰摂取による健康障害のリスクを下げるための上限量が設定されている。
[河野友美・山口米子]
『藤原彰夫・岸本菊夫著『燐と植物1 燐の農学と農業技術』『燐と植物2 燐の工学と工業技術』(1988、1993・博友社)』▽『井上勝也監修、金沢孝文著『リン――謎の元素は機能の宝庫』(1997・研成社)』▽『小田部廣男著『リン鉱石とリン資源』(1997・日本燐資源研究所)』▽『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』▽『鈴木正司・秋澤忠男編『腎不全とリン』(2004・日本メディカルセンター)』▽『菱田明・佐々木敏監修『日本人の食事摂取基準2015年版――厚生労働省「日本人の食事摂取基準」策定検討会報告書』(2014・第一出版)』
リン(データノート)
りんでーたのーと
リン(白リン)
元素記号 P
原子番号 15
原子量 30.97376
融点 44.1℃
沸点 280.5℃
比重 1.82
結晶系 立方
元素存在度 宇宙 1.27×104(第16位)
(Si106個当りの原子数)
地殻 1050ppm(第10位)
海水 60μg/dm3
改訂新版 世界大百科事典 「リン」の意味・わかりやすい解説
リン(燐) (りん)
phosphorus
1669年ドイツの錬金術師ブラントH.Brandが銀を黄金に変える液体を作ろうとして尿を空気を遮断して強熱した際に発見した非金属元素の一つ。後に多くの人によっても同様の方法で作られたが,暗中でみずから光を発するという性質があるため注目された。英名は光phōsの運搬者phorosを意味するギリシア語に由来する。単体として天然には得られないが,金属のリン酸塩たとえばリン灰石をはじめとして,多くのリン酸塩鉱物として広く産する。また海水中に少量含まれるほか,動物や植物にも含まれ,生物化学的に重要な役割を果たしている。親生元素の代表的なものである。
製法
リン酸カルシウムを含むリン鉱石,ケイ砂,コークス(あるいは天然ガス)を混合して電気炉中で1200~1400℃で融解し,生成したリン蒸気を冷却,凝縮して水中で回収すると黄リンが得られる。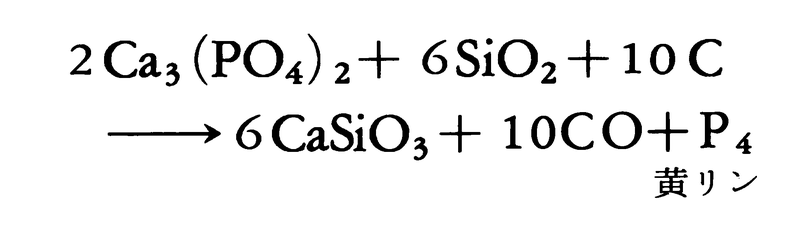
得られた黄リンは,微粒子としてから硝酸で洗浄すればヒ素,セレン,硫黄などの不純物を取り除くことができる。また,アルミニウム,鉛などと融解して不純物を合金として除く方法や,水蒸気蒸留法,ゾーンメルティングなどによってさらに精製することもできる。
単体リンには多くの変態があるが,同素体として白リン,紫リン,黒リンの3種が主要なものである。通常得られる黄リンは淡黄色で透明な蠟状であるが,純粋なら無色であり,本来白リンと呼ばれるもので,白リンの表面に赤リンの少量が生じて淡黄色を呈しているといわれている。白リンではリンは固体,液体,および溶液中でP4分子(正四面体,結合間隔P-P=2.21Å,結合角60°)として存在している。しかし800℃以上の気体ではP2分子への解離がみられる。白リンを鉛容器中で空気を断って500℃で10日間熱すると紫リンが得られる。白リン(黄リン)を320~340℃で3~4日間熱するか400℃で数時間熱して得られる赤リンは,白リンと紫リンの固溶体であると考えられており,赤褐色固体である。また白リンをきわめて高い圧力下で熱するか,触媒を入れて220~370℃で8日間熱すると金属光沢のある黒リンが得られる。熱,電気の導体である。その他,紅リン,無定形リンなどと呼ばれる変態も存在する。
性質
リンは陽イオンになりにくく,また他から電子をもらって陰イオンP3⁻となり希ガス元素の電子構造となるにもかなりのエネルギーを必要とする。したがって周期表中の同じ第VB族に属する窒素に似て本質的には共有結合性化合物を作る傾向が強い。白リン(黄リン)は最も化学的活性が強く,空気中で50℃で発火燃焼して主として五酸化二リンP2O5(P4O10)を生ずる。湿った空気中では徐々に酸化され,暗所では青白色の微光(リン光)を放つ。したがって白リンは水中に空気を遮断して蓄えなければならない。猛毒で,致死量0.1g。赤リンは空気中で安定であり発火点は260℃である。黒リンは最も安定であり発火させるのも困難である。
白リンは多くの金属および半金属と反応してNa3P,Ca3P,CoP,Co2P,FePなどのリン化物をつくる。Na3Pはリンの化合物のなかで例外的にP3⁻を含むイオン結合性の強い化合物である。硫黄とは1000℃以上で直接反応してP4S3,P4S5などの硫化物となる。白リンに水酸化カリウムを作用させると,リンの水素化合物であるホスフィンPH3が生成する。
4P+3KOH+3H2O─→PH3+3KH2PO4
PH3は還元力が強く,また猛毒である。リンに直接,塩素,臭素を反応させると,PCl3,PCl5などのハロゲン化リンを生ずる。PCl5とCaF2を300~400℃で反応させるとPF5が得られる。
用途
黄リンは乾式リン酸製造法によって大量に生産され,リン酸,リン酸塩あるいは三塩化リン,五塩化リンなどハロゲン化リンとされて,肥料,医薬品,染料,媒染剤,食品工業,可塑剤,界面活性剤,重合触媒などとして広く用いられている。赤リンはマッチ,リン青銅などの用途がある。リンは半導体材料としても重要な役割を果たしており,最近ではインジウム,ガリウム,ヒ素,リンを原料として作られる発光ダイオードは,信頼性,寿命,温度変化特性に優れ,光ファイバーを用いる比較的短距離の光通信システムの光源として注目されている。
なお,黄リンは皮膚に触れると火傷を起こし,毒性が強いのでゴム手袋,ピンセットなどで取り扱い,水中,暗所に保存する。
執筆者:漆山 秋雄
生体とリン
リンは生体の必須構成元素の一種で,生体内ではほとんどがリン酸として存在し,核酸,リン脂質,リンタンパク質,その他の化合物となり,さまざまな機能を果たす。核酸中ではリン酸ジエステルとして,糖とともにポリヌクレオチド鎖の骨格を形成する。リン脂質中ではリン酸エステルの型で存在する。グリセロリン脂質とスフィンゴリン脂質とに分類され,糖脂質,グリセロールとともに生体膜を構成する。多数のリンタンパク質(牛乳中のカゼイン,卵黄のビテリンなど)が知られ,プロテインキナーゼによりセリンやトレオニンなどのアミノ酸の水酸基にリン酸が結合する。ATPを代表例とする高エネルギーリン酸結合(〈高エネルギー結合〉の項参照)は,エネルギー代謝における最も重要な概念である。またFMN(フラビンモノヌクレオチド),FAD(フラビンアデニンジヌクレオチド)をはじめ,リン酸を含む補酵素も多数知られている。動物の骨格中には,リン酸カルシウム塩として多量に存在する。
執筆者:柳田 充弘
リン
Lynn
アメリカ合衆国マサチューセッツ州北東部にある工業都市。人口8万9050(2000)。1629年の町の創設以来,製造業が発達し,現在もゼネラル・エレクトリック社の工場がおかれ,発電機,ジェットエンジンなどが製造されている。リンは歴史的には製靴業が有名で,19世紀中葉においては,同産業が盛んであったニューイングランド地方の中心地であった。リンの靴生産高は,フィラデルフィアやニューヨーク市と肩を並べ,とくに機械(ミシン)による生産と工場制度の導入において先駆者的役割を果たした。従来,靴の生産は職人による家内産業として行われていたが,工場生産の開始は彼らの生活を脅かした。このような背景に1857年恐慌による不景気が加わり,60年には靴職人の大ストライキが起こった。このストライキは近隣諸地域の靴職人をもまきこみ,〈南北戦争前におけるアメリカ最大のストライキ〉として知られている。
執筆者:岡田 泰男
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「リン」の解説
リン
リン
phosphorus
P.原子番号15の元素.電子配置[Ne]3s23p3の周期表15族元素.原子量30.973762(2).天然には質量数31の核種のみ存在する単核種元素の一つ.質量数24~46の放射性核種が知られる.32Pは半減期14.3 d でトレーサーとして多用される.錬金術時代(1669年)にH.Brandにより尿中に黄リンが発見され,りん光を発することから“光を運ぶ”という意味のギリシア語 ωσ
ωσ ορο
ορο (fosforos)から命名された.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,波斯波律斯(ホスホーリュス)燐と記載している.
(fosforos)から命名された.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,波斯波律斯(ホスホーリュス)燐と記載している.
主要鉱物として,りん灰石(アパタイト,Ca5F(PO4)3),藍(らん)鉄鉱Fe3(PO4)2・8H2O,銀星石Al3(PO4)2(OH)3・5H2Oなど.埋蔵量ではモロッコとサハラ西部42%,中国26%,アメリカ7%.産出量(2007年)では中国24%,アメリカ20%,モロッコとサハラ西部19%.リン酸カルシウム(リン鉱石,骨灰,海鳥ふん)にケイ酸を混合し,炭素(コークスなど)で還元すると,リンが気体の P4 として蒸留される.これを急冷して白リン(黄リン)をつくる.融点44.2 ℃,沸点280 ℃,密度1.82(白リン(黄リン)),2.2(赤リン).2.69(黒リン)g cm-3(20 ℃).リンの変態には P4 分子からなる非金属性の白リンとグラファイトに似た金属リンとがある.黄リン,赤リン,紅リンはこれらの変態の固溶体,紫リン,黒リンは金属リン変態とされている.導電性,化学反応性,溶解度,毒性などが変態によりいちじるしく差がある.白リンは絶縁体,黒リンは半導体.白リンは水に不溶,二硫化炭素に可溶.空気中で自然発火して十酸化四リンP4O10となる.光(日光)照射または自己の蒸気存在下の加熱により,赤リンにかわる.工業的には,黄リンを水相中で沸点以下でゆっくり加熱転化すると得られる.二硫化炭素に不溶.417 ℃(大気圧)で昇華する.リンは硝酸によりリン酸となり,濃い水酸化ナトリウム溶液ではリン化水素PH3とホスフィン酸ナトリウムNaPH2O2を生じる.酸素,塩素とははげしく反応し,酸化数5のP4O10(五酸化二リンではない)および五塩化リンとなる.
黄リンとしては発煙剤などの直接利用もあるが,毒性,反応性がともに少ない赤リンの形で使われることが多い.多くのリン化合物製造の出発物質となる.リンはリン青銅とよばれる合金の材料にもなるが,多くはリン酸化合物として肥料,そのほか,金属表面処理液,医薬品,農薬,洗剤,食品,樹脂の可塑剤,難燃剤などに利用される.わが国の需要の80% は肥料である.リン酸イオンはDNAや生物のエネルギー源ATP,骨・歯の構成物質として生物に不可欠の元素として重要である.リンの化合物は酸化数-3~5まであり,縮合ポリリン酸,過酸化物のベルオキソリン酸も得られている.有機リン酸化合物中には化学兵器として利用されるサリン,ソマン,タブン,VXなどがある.「黄リン(別名白リン)」は,毒物および劇物取締法毒物,大気汚染防止法・特定物質,大気汚染防止法・有害大気汚染物質,労働安全衛生法〔名称等表示〕名称等を通知すべき有害物,消防法〔危険物〕危険物第3類,海洋汚染防止法・A類物質等となっている.皮膚に触れると火傷を生じ,経口摂取により中枢神経系およびほかの全身性作用,肝臓に急性作用があり,重篤な眼の損傷を起こす,きわめて危険な猛毒物質である.[CAS 7723-14-0][別用語参照]リン化物
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
普及版 字通 「リン」の読み・字形・画数・意味

16画
[字形] 形声
声符は
 (りん)。〔玉
(りん)。〔玉 〕に「玉色光
〕に「玉色光 あるなり」とあり、玉光をいう。
あるなり」とあり、玉光をいう。[訓義]
1. たまのひかり。
2. たまのあやあるさま。
[古辞書の訓]
〔名義抄〕
 マダラナリ・マダラカニ 〔字鏡集〕
マダラナリ・マダラカニ 〔字鏡集〕 マダラナリ・マダラカニ・ウスシ・タマノイロ
マダラナリ・マダラカニ・ウスシ・タマノイロ[熟語]
 ▶・
▶・
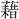 ▶・
▶・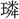 班▶・
班▶・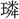 斌▶・
斌▶・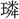 彬▶・
彬▶・
 ▶
▶[下接語]
石
 ・
・
出典 平凡社「普及版 字通」普及版 字通について 情報
百科事典マイペディア 「リン」の意味・わかりやすい解説
リン(燐)【りん】
→関連項目下水処理場
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「リン」の意味・わかりやすい解説
リン
phosphorus
リン
Lynn, Ralph
[没]1962.8.8. ロンドン
イギリスの俳優。 1900年にデビュー。喜劇やファルスを演じて人々に親しまれた。代表的舞台は『うなるほどある金』 (1922) ,『新婚旅行はほんとうに必要か』 (44) で,ともに2年間のロングランとなった。 29年以後は映画にも出演したが,58年引退。
リン
Lynn
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
食の医学館 「リン」の解説
リン
栄養・生化学辞典 「リン」の解説
リン
関連語をあわせて調べる
《〈和〉doctor+helicopterから》救急専用の医療機器を搭載し、医師・看護師が乗り込んで患者のもとに急行し、病院などに搬送する間に救命医療を施すことのできる救急ヘリコプター。...





