精選版 日本国語大辞典 「炭酸マグネシウム」の意味・読み・例文・類語
たんさん‐マグネシウム【炭酸マグネシウム】
- 〘 名詞 〙 ( マグネシウムは[英語] magnesium ) マグネシウムの炭酸塩。化学式 MgCO3 無色、菱面(りょうめん)体の結晶。ほかに一・三・五水塩がある。天然には菱苦土(りょうくど)石(マグネサイト)として産出。これを脱水すると無水塩が得られる。加熱すると二酸化炭素を放って分解し酸化マグネシウムとなる。耐火物原料、二酸化炭素の発生原料などに用いられる。
- [初出の実例]「炭酸カルシウム、炭酸マグネシウム〈略〉の如き薬品に香料を加へたものが安全であります」(出典:欧米最新美容法(1908))
日本大百科全書(ニッポニカ) 「炭酸マグネシウム」の意味・わかりやすい解説
炭酸マグネシウム
たんさんまぐねしうむ
magnesium carbonate
炭酸のマグネシウム塩。炭マグとよばれることがある。天然にはマグネサイト(菱苦土石(りょうくどせき))として産出する。マグネシウム塩の水溶液に二酸化炭素を通じながら炭酸ナトリウムを加えると、通常三水和物として沈殿する。二酸化炭素気流中で乾燥脱水すると三方晶系の無水和物(式量84.3)が得られる(ほかに一および五水和物も知られる)。加熱により容易に分解し、二酸化炭素を放って酸化マグネシウムになる。水にはわずかに溶ける。純水中では次式に従って加水分解するとみなすことができる。
MgCO3+2H2O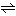 Mg(OH)2+H2O+CO2
Mg(OH)2+H2O+CO2
そのため、二酸化炭素が過剰に存在しない状態でつくったものは一般に4MgCO3・Mg(OH)2・4H2Oに近い組成をもっている。この塩基性塩は炭酸マグネシウムそのものよりも化学的に活発で酸にもよく溶けるので、マグネシウム塩の原料となる。また、微粒子状のものは歯みがき、化粧品、紙、ゴムの充填(じゅうてん)剤に用いられる。医薬に用いるマグネシアアルバもこの物質である。天然のマグネサイトは焙焼(ばいしょう)して酸化マグネシウムとし、耐火物の原料として使用される。
[鳥居泰男]
改訂新版 世界大百科事典 「炭酸マグネシウム」の意味・わかりやすい解説
炭酸マグネシウム (たんさんマグネシウム)
magnesium carbonate
化学式MgCO3。天然にはリョウ苦土鉱(マグネサイト)として産出し,またドロマイト(白雲石,苦灰石)は炭酸カルシウムとの複塩MgCO3・CaCO3である。マグネシウム塩の水溶液に炭酸アルカリを加えると,mMgCO3・Mg(OH)2・nH2O(m=3~5,n=3~7)の組成をもつ塩基性炭酸マグネシウムの白色沈殿を生ずる。薬用・工業用には,これを炭酸マグネシウムと呼ぶこともある。これを炭酸水素アルカリの濃溶液と長く放置または加熱したり,マグネシウム塩溶液に二酸化炭素を通じながら炭酸ナトリウムを加えると,炭酸マグネシウムの3水和物MgCO3・3H2O(比重1.85)が得られ,これを二酸化炭素気流中で加熱すれば無水和物MgCO3(比重3.03)となる。無水和物は,方解石と同じ構造の菱面体の無色の結晶で,炭酸カルシウムよりはるかに低い温度(540℃)で二酸化炭素を放って分解する。
MgCO3─→MgO+CO2
水に対する溶解度は9.4mg/100g(18℃)。酸および二酸化炭素水溶液に溶ける。100℃で結晶水を失う上記の3水和物のほか,条件によって5水和物,1水和物も生ずる。なお塩基性炭酸マグネシウムは,古くからマグネシア・アルバmagnesia-albaと呼ばれ,ゴム補強剤,医薬品類(たとえば歯磨き)の原料などとして使われてきた。
執筆者:曽根 興三
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「炭酸マグネシウム」の解説
炭酸マグネシウム
タンサンマグネシウム
magnesium carbonate
MgCO3(84.31).天然にはりょう苦土鉱として産出する.マグネシウム塩水溶液に二酸化炭素を通じながら炭酸ナトリウムを加えると三水和物が得られる.二酸化炭素気流中で乾燥すると無水物が得られる.無水物は無色のりょう面体結晶.密度3.04 g cm-3.水に難溶.加熱すると分解して二酸化炭素と酸化マグネシウムを生じる.三水和物は無色の斜方晶系結晶.密度1.85 g cm-3.100 ℃ で無水物となる.炭酸マグネシウムの懸濁水溶液を加熱すると炭酸水酸化マグネシウム(塩基性炭酸マグネシウム)Mg(OH)2・3MgCO3・3H2Oを生じ,このものは無色の斜方晶系粉末.密度2.16 g cm-3.医薬品,歯磨き粉,マグネシアの製造などに用いられる.天然の鉱石は熱分解して酸化マグネシウムとして,耐火物の原料,防火塗料,印刷インキ,肥料として用いられる.[CAS 546-93-0:MgCO3][CAS 39409-82-0:Mg(OH)2・3MgCO3・3H2O]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「炭酸マグネシウム」の意味・わかりやすい解説
炭酸マグネシウム
たんさんマグネシウム
magnesium carbonate
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「炭酸マグネシウム」の解説
炭酸マグネシウム
世界大百科事典(旧版)内の炭酸マグネシウムの言及
【制酸薬】より
…炭酸カルシウムの1.0gは1/10規定の塩酸200mlを中和する。炭酸カルシウムと水酸化アルミニウムは便秘を起こす傾向があり,炭酸マグネシウムは下剤作用を有する。実際には,各種制酸薬の利点と欠点を配合のくふうにより相補うような製剤が用いられている。…
※「炭酸マグネシウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
目次 飼養文化 北アメリカ 北方ユーラシア偶蹄目シカ科の哺乳類。北アメリカでは野生種はカリブーcaribouと呼ばれる。角が雄だけでなく雌にもふつうある。体長130~220cm,尾長7~20cm,...

