精選版 日本国語大辞典 「硝酸」の意味・読み・例文・類語
改訂新版 世界大百科事典 「硝酸」の意味・わかりやすい解説
硝酸 (しょうさん)
nitric acid
化学式HNO3。すでに8世紀ころ,アラビアで硝石と硫酸銅とミョウバンとからつくられていたといわれる。硫酸と硝石から硝酸をつくる方法はドイツのJ.R.グラウバーによって考案され17世紀から行われた。
性状
濃硝酸はしばしば光化学反応によってNO2を生じ黄褐色になっている。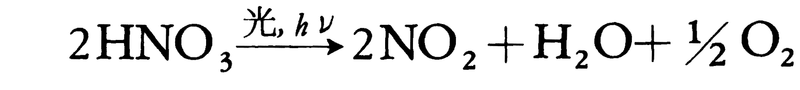
濃硝酸は強力な酸化剤であり,金,白金,ロジウム,イリジウムのような貴金属のみが侵されない。また塩酸を酸化して塩素を遊離する。王水に金,白金などが溶けるのはこの発生期の塩素の作用による。アルミニウム,鉄,クロムなどでは表面に不働態をつくって反応しないが希硝酸には溶ける。ほとんどすべての金属と水溶性の塩をつくる。無水塩もつくり,その多くは昇華性がある。無色の液体で,比重1.502,融点-42℃,沸点86℃。
硝酸イオンは平面型構造をもち(図),遷移金属イオンには,一座配位子(例[Co(NO3)(NH3)5]2⁺),あるいは二座配位子(例[Co(NO3)4]2⁻,8配位)として働く。
有機化合物に作用させると,ニトロ基-NO2をもつニトロ化合物および-ONO2基をもつ硝酸エステルをつくる。この反応はニトリルイオン(ニトロニウムイオン)NO2⁺によって起こる。
2HNO3─→NO2⁺+NO3⁻+H2O
NO2⁺の生成は濃硫酸の存在によって促進される。
HNO3+H2SO4─→NO2⁺+HSO4⁻+H2O
無水酢酸と硝酸からは硝酸アセチルCH3
COO⁻NO2⁺が生成するのでニトロ化に使われる。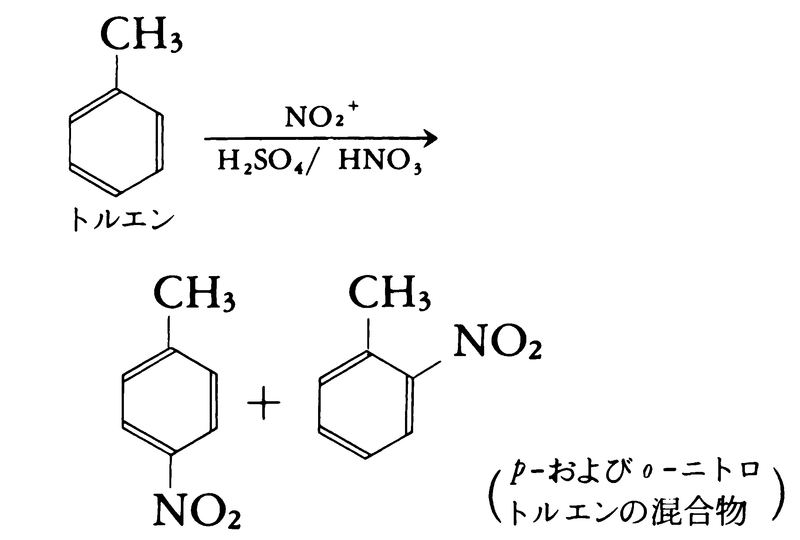
芳香族ニトロ化合物はアミノ化合物からさらにジアゾニウム塩を経ていろいろな化合物に変えることができ,合成中間体としてきわめて重要である。吸入すると呼吸器を侵す。濃硝酸が皮膚に触れると黄色くなる。キサントプロテイン反応と呼ばれているもので,ベンゼン環を有するアミノ酸,あるいはそれらを含むタンパク質に対する呈色反応で,ベンゼン環がニトロ化されるためである。
執筆者:漆山 秋雄
工業的製造法
19世紀中葉からチリ硝石NaNO3の硫酸分解によりつくられ,20世紀初頭には空気のみを原料とする電弧式硝酸合成法(N2+O2─→NO)が試験された。前者は資源枯渇により,後者は電力消費量が大きく,生成NO濃度が僅少のため,長くは利用されなかった。現在は,1902年F.W.オストワルトの研究になるアンモニア酸化法(オストワルト法)によりもっぱら生産されている。
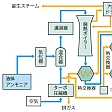
(1)希硝酸 製造工程は次の3部分からなる。(a)アンモニアを酸化して酸化窒素をつくり,(b)二酸化窒素まで酸化を進め,(c)水に吸収させて硝酸を得る。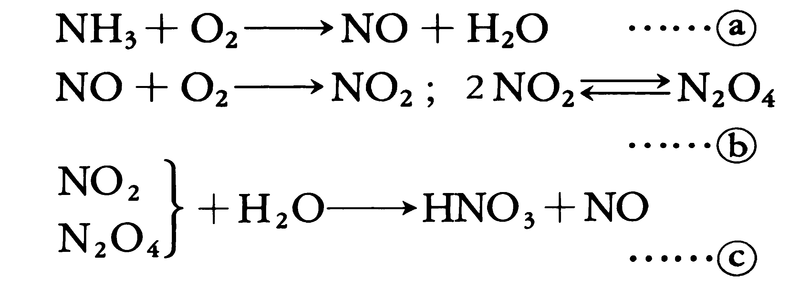
(a)では700~900℃に保持した白金網触媒上にアンモニアガスを通して空気または酸素により短時間の接触的酸化(10⁻4秒程度)を行わせる。95~98%の酸化収率である。生成高温NOガスを冷却すると(b)が進行する。低温では一部が会合して四酸化二窒素N2O4となる。これらから(c)により硝酸を得るが,この際一酸化窒素NOが発生するので,再び(b)の循環を行う。以上の工程で60~65%(重量)の希硝酸が得られる。酸化・吸収の各工程を常圧にするか加圧(3~9気圧程度)にするかで,いくつかの方式に分けられる。
(2)濃硝酸 希硝酸に脱水剤として濃硫酸または硝酸マグネシウムMg(NO3)2濃厚水溶液を加え蒸留する。あるいは二酸化窒素NO2(または四酸化二窒素),水,酸素(または空気)を加圧して,直接濃硝酸を合成する。98~99%の濃度が得られる。反応式は次のとおりである。 濃硝酸にNO2がさらに溶け込んでいるものを発煙硝酸という。
濃硝酸にNO2がさらに溶け込んでいるものを発煙硝酸という。
用途
硝酸は強酸であり,酸化剤として用いられるほか,硝酸塩(工業用硝安など),ニトロ化合物(ニトログリセリン,ニトロセルロースなど),染料中間物,合成繊維(アクリロニトリル系),火薬,爆薬の原料,硝酸性窒素を含む窒素肥料または複合肥料の原料,めっき,酸洗用などの用途がある。
執筆者:金澤 孝文
硝酸塩
広義には硝酸HNO3の水素原子Hを基または金属原子で置換した化合物をさす。たとえば硝酸カリウムKNO3,硝酸エチルC2H5NO3などである。一般式はMINO3で示される。金属,金属酸化物,炭酸塩などを硝酸に溶解して得られる。ほとんどすべての硝酸塩は水に溶けるが,硝酸イオンNO3⁻の特異試薬であるニトロンnitronやいくつかの複雑な有機塩基との付加化合物の塩は水に難溶である。一般に吸湿性があり,含水塩として存在する。ただしカリウム,バリウム,銀,鉛の塩は吸湿性がない。一般に無色であるが,金属塩は金属イオンの種類によって着色している場合がある。加熱によって酸素を放出し亜硝酸となるが,重金属塩はさらに加熱をつづけると二酸化窒素と金属酸化物になる。硝酸塩は有機化合物や酸化されやすい金属との混合によって混合火薬類などの爆発性物質を生成する。有機硝酸塩としては前記のニトロン塩のほか有機化合物との付加化合物も知られている。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「硝酸」の意味・わかりやすい解説
硝酸
しょうさん
nitric acid
酢酸、硫酸に次いで古くから知られている酸の一つで強酸。化学式HNO3で示される化合物、あるいはその水溶液をいうが、普通は後者をさすことが多い。
[守永健一・中原勝儼]
歴史
古く8世紀ごろ、アラビアにおいて緑礬(りょくばん)FeSO4・7H2OまたはミョウバンKAl(SO4)2・12H2Oと硝石KNO3とを混合して蒸留することによってつくられていた。17世紀になってドイツのグラウバーがこれを改良し、ビトリオール油(濃硫酸)と硝石との混合物を蒸留し、純粋な硝酸をつくった。銅、銀などを溶かすことから、ビトリオール油よりも強いということで、「強い水」という意味のラテン語をとりaqua fortisといわれ、また硝石の精という意味からイギリスではspirit of nitreともいわれていた。硝酸ということばは、1879年にフランスのラボアジエによってフランス語でacid nitriqueと命名されて以来用いられるようになった。
[守永健一・中原勝儼]
製法
実験室では硝酸アルカリに硫酸を作用させ、100~120℃に熱して蒸留してつくる。工業的には、19世紀末から20世紀初めにかけて、チリ硝石NaNO3と硫酸の複分解を用いる方法や、放電によって空気中の窒素と酸素とを化合させ、生じた窒素酸化物を水に吸収させ硝酸とする電弧法が行われていた。現在ではアンモニア酸化法が用いられる。オストワルト法ともいわれ、アンモニアを酸素によって酸化してから水に吸収させてつくる。
4NH3+5O2→4NO+6H2O
2NO+O2→2NO2
3NO2+H2O→2HNO3+NO
すなわち、アンモニアと空気を混合し(アンモニア約10%)、700~900℃に加熱した白金合金(ロジウム10%)を触媒として酸化する。生成ガスを冷却すると二酸化窒素に変わる。これを水に吸収させるとき発生する一酸化窒素は、吸収塔内で酸素により二酸化窒素となってふたたび吸収される。この過程が繰り返されて硝酸の濃度が高くなる。水による吸収は圧力が高いほど効率がよいので、酸化工程を常圧にし吸収工程のみを加圧する方式や、両工程を加圧する方式などがあるが、得られる硝酸濃度は普通60~65%である。硝酸は69.8%で最高沸点123℃をもつので、蒸留だけではこれ以上に濃縮することができない。98~100%濃硝酸を得るには、脱水剤として濃硫酸または無水硝酸マグネシウムを加えて蒸留する。また、四酸化二窒素を希硝酸とともに高圧釜(がま)に入れて酸素を吹き込んで、直接濃硝酸を得る方法もある。濃硝酸にさらに二酸化窒素を溶かすと、空気中で発煙性の赤褐色溶液となる。これを発煙硝酸といっている。なお硝酸の製造工程についてはを参照。世界で約3000万トン程度、日本では60万トン生産されている(2005)。
[守永健一・中原勝儼]
性質
純粋な硝酸は無色の液体で、吸湿性が強く著しく発煙する。光に当たると一部分解する。市販の濃硝酸は60~70%、比重1.38~1.42の水溶液である。酸化力が強く、金、白金、ロジウム、イリジウムなどの貴金属以外の金属とは激しく反応し、これを溶かすが、鉄、クロム、アルミニウムなどは不動態をつくって侵されない。多くの有機化合物を酸化またはニトロ化する。濃硝酸1、濃塩酸3の割合で混合したものは王水といわれ、白金や金なども溶かす。希硝酸は強い一塩基酸であるが(電離度は1規定で82%、0.1規定で93%)、酸としての強さは、濃硝酸は同じ濃度の濃塩酸よりは劣る。また、濃硝酸を冷暗所以外に置くと、日光などの作用で徐々に分解し黄褐色となる。強い酸化剤で、硫黄(いおう)、リンなどと熱すると、それぞれ硫酸、リン酸などを生じる。希硝酸にも酸化作用があるので、銅、銀、水銀なども窒素酸化物を生じて希硝酸に溶ける。
[守永健一・中原勝儼]
用途
硝酸やリン硝安肥料など肥料用、硝酸ナトリウム、鉛室法硫酸(二酸化硫黄の酸化)、ニトログリセリン、ニトロセルロース、TNT、ピクリン酸など火薬の原料となるニトロ化合物の合成、セルロイド、染料(アゾ染料、アニリン染料など)、顔料、アジピン酸や化学繊維などの製造原料として用いられるほか、めっきや酸洗用、医薬品として収斂(しゅうれん)剤その他に用いられる。また、濃硝酸はアミン類と急激に反応分解するので、ロケット推進薬の酸化剤として用いられる。劇薬で、皮膚、口、食道、胃などを冒す。また、発煙硝酸を吸入しても気管を侵し、肺炎となるおそれがある。大気中の許容濃度は10ppmである。
[守永健一・中原勝儼]
硝酸(データノート)
しょうさんでーたのーと
硝酸
HNO3
分子量 63.0
融点 -42℃
沸点 86℃
比重 1.502(室温)
屈折率 (n )1.397
)1.397
百科事典マイペディア 「硝酸」の意味・わかりやすい解説
硝酸【しょうさん】
→関連項目空中窒素固定|工業中毒|酸性雨
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「硝酸」の解説
硝酸
ショウサン
nitric acid
HNO3(63.01).アンモニアの接触酸化(アンモニア酸化法)で工業的に多量につくられる.市販の硝酸は69.08% の水溶液で,沸点123 ℃ の共沸混合物である.密度1.42 g cm-3.市販の硝酸に濃硫酸を加えて蒸留し,五酸化リンを入れた容器に受けると無水の純硝酸が得られる.純硝酸は無色の液体.融点 -42 ℃,沸点86 ℃.密度1.50 g cm-3.吸湿性で空気中で発煙する.光分解を受けるとNO,O2 を生じる.硝酸中のおもな不純物は亜硝酸である.濃い硝酸は冷暗所に貯蔵する.強い酸化剤で,硫黄,リンを酸化して溶かし,硫酸,リン酸を生じる.不動態にならない金属をよく溶かす.金,白金,イリジウムとは反応しない.肥料の硝安,工業用火薬の製造,ロケット燃料,硝酸塩の製造,冶金,有機合成などに用いられる.皮膚や粘膜をおかす.[CAS 7696-37-2][別用語参照]硝酸の製造
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「硝酸」の意味・わかりやすい解説
硝酸
しょうさん
nitric acid
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「硝酸」の解説
硝酸
関連語をあわせて調べる
「歓喜の歌」の合唱で知られ、聴力をほぼ失ったベートーベンが晩年に完成させた最後の交響曲。第4楽章にある合唱は人生の苦悩と喜び、全人類の兄弟愛をたたえたシラーの詩が基で欧州連合(EU)の歌にも指定され...