マンガン(読み)まんがん(その他表記)manganese
精選版 日本国語大辞典 「マンガン」の意味・読み・例文・類語
マンガン
まん‐がん【
 】
】
- 〘 形容動詞ナリ活用 〙 ( もともとは「大きな顔」の意 ) ぐずぐずして、しまりのないさまか。〔文明本節用集(室町中)〕
- [初出の実例]「漫郎はまんくゎんななりぞ」(出典:黄烏鉢鈔(1500頃)五)
日本大百科全書(ニッポニカ) 「マンガン」の意味・わかりやすい解説
マンガン
まんがん
manganese 英語
Mangan ドイツ語
周期表第7族に属し、マンガン族元素の一つ。1774年スウェーデンのK・W・シェーレによりその存在が推測され、同年、彼の友人ガーンJohan Gottlieb Gahn(1745―1818)は軟マンガン鉱(二酸化マンガンMnO2、酸化マンガン(Ⅳ)ともいう)を油と木炭粉末で覆い、るつぼ中で強熱して金属マンガンを得た。軟マンガン鉱は当時、磁鉄鉱magnesの変種とも考えられていてmagnesiaとよばれていた。そのころ酸化マグネシウムもmagnesiaとよばれており、それを区別するため軟マンガン鉱を黒いmagnesiaおよびmanganeseとよんだ。そのためガーンは、ここで得た金属をmanganesiumとした。1808年ドイツのクラプロートはそれまでに発見されたmagnesiumとの混同を防ぐためMangan(ドイツ語)を提案した。また、古代ローマ時代、すでにガラスに加えて青緑色を消すため軟マンガン鉱を利用しており、これにちなんだギリシア語のmanganizo(浄化)、manganon(魔法)に、その名前の語源があるともいわれる。
[守永健一・中原勝儼]
存在と製法
鉄に次いでもっとも広く分布する重金属であるが、遊離状態では産出しない。おもな鉱石は、軟マンガン鉱、ブラウン鉱3Mn2O3・MnSiO3、水マンガン鉱Mn2O3・H2O、サイロメレン鉱、菱(りょう)マンガン鉱などである。その他深海底などにはマンガンと鉄の酸化物がマンガン団塊として広く分布している。金属を得るには、二酸化マンガンを加熱して四酸化二マンガン(Ⅲ)マンガン(Ⅱ)Mn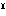 Mn
Mn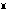 2O4(四酸化三マンガンともいう)とし、これをアルミニウムとともに強熱するテルミット法があるが、品質のよいものが得られやすい電解法が主流である。硫酸マンガン(Ⅱ)水溶液を隔膜の存在下で電解して電解マンガン(99.97%)を得る。また、鉄鋼の脱硫、脱酸、マンガン添加剤として用いる目的で、フェロマンガン(マンガン70~80%と鉄の合金)の形で製造される。フェロマンガンは、マンガン鉱石とくず鉄、コークス、石灰を電気炉内で強熱してつくる。
2O4(四酸化三マンガンともいう)とし、これをアルミニウムとともに強熱するテルミット法があるが、品質のよいものが得られやすい電解法が主流である。硫酸マンガン(Ⅱ)水溶液を隔膜の存在下で電解して電解マンガン(99.97%)を得る。また、鉄鋼の脱硫、脱酸、マンガン添加剤として用いる目的で、フェロマンガン(マンガン70~80%と鉄の合金)の形で製造される。フェロマンガンは、マンガン鉱石とくず鉄、コークス、石灰を電気炉内で強熱してつくる。
マンガン鉱石は、日本では岩手県などにごく少量産出するが、ほとんどが南アフリカ、オーストラリアなどから輸入されている。2010年のマンガンの世界の生産鉱量は年間約1390万トンで、主要国はオーストラリア(約22%)、南アフリカ(約21%)、中国(約19%)である。
[守永健一・中原勝儼]
性質
銀白色の金属。鉄に似た性質をもつが、鉄より硬くてもろい。α(アルファ)、β(ベータ)、γ(ガンマ)、δ(デルタ)の4種の同素体がある。室温ではαが安定。727℃でβとなり、βは1100℃でγ、γは1138℃でδとなる。αとβは硬くもろく、γは柔軟。粉末は発火性があるが、塊では湿った空気中ではさび、加熱水を急速に分解して水素を発生する。希酸には水素を発生して溶け、淡紅色(マンガン(Ⅱ)水和イオン[Mn(H2O)6]2+の色)の溶液となる。熱すると、ハロゲン、酸素、窒素、炭素などと直接化合する。化合物にみられるマンガンの酸化数は+Ⅱ~+Ⅶと広範囲にわたる。このうち、+Ⅱの酸化状態がもっとも安定で、硝酸塩、硫酸塩、炭酸塩などがある。+Ⅲの塩(たとえば、酢酸マンガン(Ⅲ)Mn(C2H3O2)3)は酸化剤である。フッ化物を除くと、ハロゲン化物は二価塩が得られるだけである。酸化物には+Ⅱ~+Ⅳおよび+Ⅶの酸化状態を含むものが知られる。酸化マンガン(Ⅳ)は、濃塩酸とともに熱すると塩素を発生し、酸化作用を示す。この酸化力が乾電池に利用されている。酸化状態が変化しやすいため酸化還元反応の触媒ともなる。過マンガン酸塩は強力な酸化剤であり、マンガン酸塩の水溶液は不安定で不均化しやすい。
[守永健一・中原勝儼]
用途
マンガンの添加により、強度、硬度、耐食性などの金属特性が改善されるので、鉄鋼および非鉄金属への合金添加剤として用いられる。たとえば、マンガン入り黄銅は、海水に対して耐食性があるため船のスクリューなどに使われる。また、マンガニン線(Cu80~85%、Mn10~15%、Ni2~5%、Fe1%)は、電気抵抗の温度係数が非常に小さいので、高級計測器の部品として用いられる。おもな用途は、特殊鋼(高級ステンレス鋼、電磁鋼板、非磁性鋼)や非鉄合金(アルミニウム合金、銅合金)、マンガン化合物の製造など。マンガン化合物には医薬、顔料、乾燥剤、酸化剤、分析試薬などの用途がある。すべての生物にとって必須元素であり、人体では微量元素として100万分の1程度含まれる。動物の飼料、植物の肥料などに炭酸マンガン(Ⅱ)などを少量加えて、欠乏症を防ぐために用いられる。
[守永健一・中原勝儼]
人体とマンガン
マンガンは人体に約15ミリグラム含まれ、その4分の1が骨、残りが肝臓、膵臓(すいぞう)、腎臓(じんぞう)などの臓器に含まれている。おもな生理作用は各種の酵素の構成成分で、酵素の作用を活性化することである。マンガンが不足すると成長阻害、骨格異常、糖質や脂質の代謝の異常などがおこる。また、過剰症には疲労、不眠、神経病などがある。通常の食事では不足や過剰の問題はないが、中心静脈栄養での不足例がある。食事からとるべき量については、「日本人の食事摂取基準」(厚生労働省)により、目安量、および過剰摂取による健康障害のリスクを下げるための上限量が設定されている。
[山口米子]
『佐佐木行美・高本進・木村幹・杉下龍一郎・橋谷卓成著『新教養無機化学』(1986・朝倉書店)』▽『日本化学会編『実験化学講座18 有機金属錯体』第4版(1991・丸善)』▽『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』▽『菱田明・佐々木敏監修『日本人の食事摂取基準2015年版――厚生労働省「日本人の食事摂取基準」策定検討会報告書』(2014・第一出版)』▽『経済産業調査会編・刊『鉱業便覧』各年版』
マンガン(データノート)
まんがんでーたのーと
マンガン
元素記号 Mn
原子番号 25
原子量 54.9380
融点 1240℃
沸点 1960℃
比重 α;7.44
β;7.29
結晶系 α;立方
β;立方
γ;立方
δ;体心立方
元素存在度 宇宙 8800(第18位)
(Si106個当りの原子数)
地殻 950ppm(第11位)
海水 0.2μg/dm3
改訂新版 世界大百科事典 「マンガン」の意味・わかりやすい解説
マンガン
manganese
周期表第Ⅶ A族に属するマンガン族の金属元素の一つ。パイロルース鉱(軟マンガン鉱)は古くからガラスの緑色を消すのに用いられ,同じ黒色の磁鉄鉱magnēs(磁気をもつマグネシア産の石の意)と混同されて,magnēsあるいは間違ってmanganeseと呼ばれていた。18世紀の後半にK.W.シェーレがこの違いを明らかにして未知の金属を含むことを示し,1774年に弟子のガーンJ.G.Gahn(1745-1818)が鉱石を炭とともに熱して単離に成功した。初めは種々の名前で呼ばれていたが,19世紀の後半には一般にmanganeseと呼ばれるようになった。鉄に次いで最も多く分布する重金属で,少量にはほとんどすべての場所に見いだされ,海底にもマンガン団塊(ノジュール)として存在する。天然には遊離の状態では産出しない。マンガン鉱物にはパイロルース鉱など多くの種類があり,おもな産出国はロシア,南アフリカ,オーストラリア,インド,ブラジルなどである。日本でも北海道,長野県,高知県などに産出するが,国内需要の大部分は南アフリカなどから輸入されている。
性質
銀白色の金属。反応性に富む。空気中で表面が酸化されて褐色の皮膜を生ずる。微粉末はとくに酸化されやすく,場合によっては発火性をもち,水を分解する。酸に溶けやすい。水素とは直接反応しないが,塩素,フッ素,窒素,リン,硫黄,炭素,ケイ素などと直接化合する。安定酸化数が多いが,塩類ではⅡがふつうである。マンガン(Ⅱ)塩は一般に淡いばら色を呈し,大きい常磁性磁化率をもつ。多くの金属と合金をつくる。α,β,γ,δの四つの同素体がある。転移温度はα⇄βが700℃,β⇄γが1079℃,γ⇄δが1143℃。結晶構造は,α,βは立方晶系,γは室温では面心正方格子,高温では面心立方格子,δは体心立方格子である。α,βは硬くてもろく,成形加工ができない。γは柔軟性があり,曲げや切断加工が容易である。
製法
主要な鉄合金で,マンガンの用途のうちで最も使用量の多いフェロマンガン(フェロアロイ)は,鉱石と,屑鉄,コークス,石灰石とを電気炉で還元してつくられる。マンガン75~85%,鉄12~16%を含み,含有される炭素量によって,高炭素(C7.5%以下),中炭素(C2.0%以下),低炭素(C1.0%以下)に分類される。金属マンガンの製造には一般に電解法が採用される。鉱石を700℃で還元焙焼(ばいしよう)して酸化マンガン(Ⅱ)MnOとして,硫酸を含む電解廃液で溶かし,水溶液中のMnより電気化学的に貴な金属イオンを硫化物として水溶液から除いた後,隔膜電解を行う。陰極液はMn2⁺12g/l,(NH4)2SO4130~140g/l,pH1.0~1.4(陽極),7.2~7.6(陰極),液温35℃,陰極にはステンレス鋼,陽極には銀1%を含む鉛合金を用いて電解する。電池用の二酸化マンガンは,金属マンガンをつくるほど液を浄化する必要はなく,またpHも低い状態で隔膜を用いずに電解し,陽極にMnO2として析出させる。陰極では水素のみが発生する。
用途
マンガンは単独ではほとんど用いられないが,合金の形で広く用いられる。最も重要な用途は鋼材の脱酸,脱硫用で,フェロマンガンや鏡鉄(スピーゲルspiegel)の形で大量に使われる。その他,マンガン鋼(Mn10~14%),ホイスラー合金(Cu55%,Mn30%,Al15%。強磁性を示すことで著名),マンガニン(標準抵抗用),ジュラルミン,マンガン青銅などとして用いられる。
執筆者:近藤 幸夫+後藤 佐吉
生体とマンガン
マンガンは生体に必須な微量元素の一種で,植物では欠乏すると葉の白化が起こる。動物では各種の臓器にみられるが,特に毛や骨に多い。マンガンが欠乏すると,ラットで生殖機能に異常をきたしたり,ニワトリで関節の異常などが起こる。マンガンを必須とする酵素は,グルタミン合成酵素などのアミノ酸代謝に関与するもの,エノラーゼなどの糖代謝に関するもの,アセチルCoAカルボキシラーゼなどの脂質代謝に関与するものなどが多数知られている。また,二枚貝のハボウキガイの仲間(Pinna属)の血液色素ピンナグロビンpinnaglobin中にもマンガンが含まれる。
執筆者:柳田 充弘
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「マンガン」の解説
マンガン
マンガン
manganese
Mn.原子番号25の元素.電子配置[Ar]3d54s2の周期表7族遷移金属元素.原子量54.938045(5).安定核種が質量数55の同位体のみの単核種元素.質量数44~69の放射性同位体核種が知られる.1774年スウェーデンのK.W. Scheele(シェーレ)がパイロルース鉱中に新しい元素の存在を提唱し,協力者のJohann G.Gahnが同年,分離に成功した.元素名はパイロルース鉱の当時の名称“黒いマグネシア”Magnesia nigerを意味するラテン語magnesから.そのため,しばらくはマグネシウムとよばれた.マグネシアは錬金術の賢者の石の重要な成分と考えられていた.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,満瓦紐母(マンガニュム)と記載している.日本語の元素名はドイツ語の元素名から.
パイロルース鉱MnO2が主要鉱石.そのほか,酸化物,水和酸化物,炭酸塩などの形で産出する.世界の確認埋蔵量の80% 弱が南アフリカ,10% がウクライナに存在する.海底にもマンガンノジュールとして大量に存在する.わが国はマンガン全量を鉱石(南アフリカ,オーストラリアから),フェロマンガンなど中間製品(中国,オーストラリア,南アフリカから),金属の形(中国から)で輸入している.国家備蓄対象鉱種の一つ.地殻中の存在度は1400 ppm.生物に必要な微量元素の一つ.いくつかの酵素の成分で,炭水化物,タンパク質,脂質を吸収する酵素のはたらきを助ける,骨・靱帯を強くするなどのはたらきがある.工業的金属製造法は,
(1)鉱石を還元したあと,希硫酸で浸出して,硫酸マンガン(Ⅱ)水溶液の電解,
(2)酸化物のアルミニウムによる還元(テルミット法),
などがある.フェロマンガンは鉱石の電気炉または高炉中の炭素還元で製造される.金属マンガンは銀白色であるが,炭素を含むものは灰色を帯びる.融点1244 ℃,沸点1962 ℃.密度7.44 g cm-3(20 ℃,α型).結晶構造:α(体心立方),β(体心立方),γ(面心立方),δ(体心立方)があり,転移点は次のとおり.
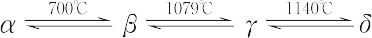
融解熱12.05 kJ mol-1.金属マンガンは鉄に類似しているが,硬くてもろく,電気的にさらに陽性である.第一イオン化エネルギー7.435 eV.標準電極電位 Mn2+/Mn-1.18 V.原子半径0.135 nm,イオン半径(配位数):Mn2+(4)0.066 nm,Mn4+(6)0.053 nm,Mn7+(6)0.046 nm.酸に溶けて水素を発生する.空気中で表面酸化,高温では酸素と反応してMn3O4を生じる.フッ素中では燃えてMnF2とMnF3とを生じ,塩素中ではMnCl2を生じる.窒素中で1200 ℃ 以上に熱するとMn3N2を生じる.そのほか水素以外の多くの非金属元素と直接化合する.普通,2~7までの酸化数をとる.1,0,-3もある.Mn-Ⅲ(CO)43-など.
用途は鋼の脱酸・脱硫のため高炉に添加するフェロマンガン用,靭性,耐摩耗性,耐食性にすぐれた特殊鋼(マンガン鋼)成分用,マンガニン(Mn 12~18質量%,Ni 5~4質量%,残り鋼の合金,標準抵抗用)など.そのほか,マンガン電池,フェライト磁石に用いられる.金属マンガンはアルミ缶用合金材料.需要の約95% は鉄鋼分野向けである.「マンガン及びその化合物」として化学物質排出把握管理促進法第一種指定,労働安全衛生法の名称等を通知すべき危険物及び有害物指定,大気汚染防止法・有害大気汚染物質/優先取組22物質の一つに指定されている.水道法水質基準は「マンガンの量に関して0.05 mg/L 以下であること」となっている.[CAS 7439-96-5]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「マンガン」の意味・わかりやすい解説
マンガン
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「マンガン」の意味・わかりやすい解説
マンガン
manganese
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
漢方薬・生薬・栄養成分がわかる事典 「マンガン」の解説
マンガン【Mangan】
食の医学館 「マンガン」の解説
マンガン
栄養・生化学辞典 「マンガン」の解説
マンガン
関連語をあわせて調べる
一度利用した製品を捨てずにそのまま再使用すること。ごみの削減に重要だとされる「3R」の一つで、衣類・服飾品や家電などさまざまな品目が取り扱われている。リユース商品の専門店やイベント、フリーマーケット...



