精選版 日本国語大辞典 「化学反応」の意味・読み・例文・類語
かがく‐はんのうクヮガクハンオウ【化学反応】
- 〘 名詞 〙 物質が、化学的変化によって他の物質に変わる過程。〔稿本化学語彙(1900)〕
改訂新版 世界大百科事典 「化学反応」の意味・わかりやすい解説
化学反応 (かがくはんのう)
chemical reaction
1種または2種以上の物質がそれ自身あるいは相互間で原子の組換えを行い,もとと異なる物質を生成する変化で,化学変化と同じ意味で使われることが多いが,とくに変化の過程を化学反応という。反応しあう物質を反応体(反応物),反応によって生じる物質を生成体(生成物)という。
化学反応と化学反応式
人類は古くから化学反応の有用性を知り,それを利用してきた。最も古くから繰り返し発見され利用されてきた化学反応は燃焼反応で,旧石器時代にすでにわれわれの祖先は火をつくり,暖をとり身を守り,また調理に利用した。現代の科学技術により,さまざまな規模の化学工場において,大量の繊維,ゴム,プラスチック,セラミックスなど,種々の機能性材料の素材となる物質から,界面活性剤,染料,香料,農薬,医薬などの種々の化学薬品がつくられ,われわれの生活の物質的基礎となっている。鉄鋼,アルミニウムなどの金属材料をつくる製錬過程でも多種類の化学反応が利用され,また,われわれの身体そのものもきわめて複雑ではあるが,よく制御され組織化された化学反応システムとみなすこともできる。
化学反応は化学結合の切断・生成による原子の組換え過程であり,化学反応によって物質の化学種の変化が起こる。化学反応に関与する各化学種の変化のようすは化学反応式で示される。たとえばメタンCH4が燃焼する反応は,
CH4+2O2─→CO2+2H2O
で表される。化学反応式は化学反応の過程で生成・消滅する各化学種の間の量的関係をも示している。物質量は,その物質を構成している基本粒子(原子,分子,イオンなど)の数で表される。その単位はmolで,1molは6.022×1023個の粒子から成り,その数をアボガドロ数という。上の化学反応式は,1molのメタンと2molの酸素O2が反応して1molの二酸化炭素CO2と2molの水H2Oを生成することを示している。
化学反応の機構
化学反応はなぜ起こるかという問題は古くから多くの人々によって考えられてきた。ギリシアのエンペドクレスは愛と憎でこれを説明し,ヒッポクラテスはものとものとの親近性の結果として起こると考えた。これが化学反応を起こす原因となる化学親和力chemical affinityの概念の芽生えであった。スウェーデンのベリマンT.O.Bergman(1735-84)は,多数の酸と塩基の組合せについて,相互に置換しあう酸と塩基の相対的な能力の差によって化学親和力の大きさを評価できると考えた。
化学反応の方向
化学反応における物質量の重要性に注目したのはフランスのC.L.ベルトレであり,ある物質に2種類の物質が競合的に反応するとき,反応量は化学親和力の相対的大きさだけに依存するのではなく,反応物質の量にも依存することを指摘した。たとえば硫酸バリウムBaSO4のような不溶性の塩も,炭酸カリウムK2CO3溶液と煮沸を繰り返すことによって溶かすことができる。このことは程度に差があるけれども,反応は次のように右向きにも左向きにも進むことを示している。
BaSO4+K2CO3⇄BaCO3+K2SO4 ……(1)
このように,化学反応は一般に正逆両方向の反応から成り,どちらか一方の向きに進むのはそのとき存在する物質の量による。ここに化学反応に対する質量作用の考え方が生まれ,親和力は一定不変の量ではないということが理解された。ベルトレが正逆両方向の反応の存在を知ったのは,ナポレオンのエジプト遠征に随伴し,湖の岸に多量の天然ソーダNa2CO3の堆積を見たときであった。彼はこれを川で運ばれた塩化ナトリウムNaClが湖岸の炭酸カルシウムCaCO3で分解されて生成したと考えた。
CaCO3+2NaCl⇄CaCl2+Na2CO3
彼は実験室でこれと逆の反応が進むことをすでによく知っていたのである。反応速度が正確な実験手法により初めて取り上げられたのは,1850年ドイツのウィルヘルミーL.Wilhelmyによってである。引き続きフランスのP.E.M.ベルトロは,酢酸とエチルアルコールとのエステル化反応で,エステルの生成速度が反応物質の量に比例すること,エステル化反応の逆反応である酢酸エチルの加水分解によってもエステル化の場合と同じ平衡点が実現することを見いだした。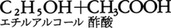
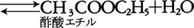
1864年,ノルウェーのC.M.グルベルグとP.ボーゲは,式(1)の平衡において,平衡点は水に可溶な反応物質(K2CO3,K2SO4)の量でほぼ決まってしまうことを見いだし,平衡状態を決定するのは質量以外に容積であるという考えに到達した。他の条件が等しければ反応の駆動力は反応物の活性質量の積に比例し,化学平衡の状態は正方向の反応と逆方向の反応の駆動力が等しいときに出現すると考えた。
化学親和力の意味
グルベルグ,ボーゲの考えにはニュートンの力学の影響がみられ,化学親和力も一種の力と考えられ,化学反応が起こるためには反応体が相互に力の及ぶ範囲にまで接近することが必要であり,活性質量とはこの力の及ぶ範囲(作用球)にある量で,濃度にほぼ対応する。この考えは質量作用の法則として定式化され,J.H.ファント・ホフによって精密化され現在に至っている。
これらの努力にもかかわらず,化学親和力の本性はなお十分には理解されなかった。反応がどこまで進むかという問題も化学親和力の大きさと関係があるはずであったが,反応速度と平衡位置との間には簡単な関係は見いだされなかった。ベルトロとデンマークのトムセンH.P.J.J.Thomsenはそれぞれ独立に,化学反応によって発生する熱量が化学親和力の尺度となるのではないかと考えた。この仮説によれば,発熱反応のみが自発的に起こることになる。しかし一連の反応熱の精密測定によって多くの反応は確かに発熱反応であるが,吸熱反応も少数ではあるが確実に起こることが確かめられ,この仮説は一般的には成り立たないことがしだいに明らかとなった。現在,化学反応が起こりうる条件は熱力学によって十分明らかにされている。一般に変化は系を構成する粒子ができるだけ乱雑な配置をとる方向に自発的に起こる。これはR.J.E.クラウジウス(1850)およびW.トムソン(1851)によって確立された原理で,熱力学の第2法則と呼ばれる。乱雑さはエントロピーの大きさによって測られ,熱力学第2法則は,自発的な変化ではつねにエントロピーは増大する,と述べられる。この法則から,温度と体積が一定のとき,
F=U-TS
で定義されるヘルムホルツの自由エネルギーFが減少する方向へ,温度と圧力が一定のとき,
G=U+PV-TS=H-TS
で定義されるギブズの自由エネルギーGが減少する方向へ,化学反応が自発的に進むことになる。ここでUは内部エネルギー,Tは絶対温度,Sはエントロピー,Pは圧力,Vは体積,そしてH=U+PVはエンタルピーである。これによると化学親和力Aは,定温定圧で,
A=-(∂G/∂ξ)t,p=-(∂H/∂ξ)t,p+T(∂S/∂ξ)t,p
で与えられる。ここでξは化学反応の進む程度を表す量で反応進度という。(∂/∂ξ)t,pを⊿で表せば,この関係は,
A=-⊿G=-⊿H+T⊿S
とも書ける。したがって定温定圧ではエンタルピーの減少が大きいほど,またエントロピーの増加が大きいほど,より化学反応は進むことになる。低温(T→0)では第1項のエンタルピー項が大きく効き,反応はほとんど発熱の方向に進み,高温では第2項のエントロピー項の寄与が大きくなり,吸熱反応も起こるようになる。
反応熱とエンタルピー収支
25℃,1気圧で窒素と水素からアンモニアを合成する反応は発熱反応であり,反応を一定温度で進めるためには,反応系にたまったエネルギーをたとえば熱の形で外部に取り出さなければならない。これが反応熱である。反応熱に符号をつけ,反応系に加える熱を正,反応系から除く熱を負とすれば,発熱反応の場合は負,吸熱反応の場合は正となる。反応熱の大きさを化学反応式に書き加え等号で結んだのが熱化学方程式である。たとえば25℃,1気圧で,
N2(g)+3H2(g)=2NH3(g)+91.80kJ
化学記号の後のgは気相を意味する。熱化学方程式に書かれた各物質の化学記号は,その物質の量ばかりでなくその物質1 mol当りのエンタルピーの値をも示しているとみなすことができる。したがってこの反応に伴われるエンタルピー収支は,次式のようになる。
⊿H=2H(NH3)-H(N2)-3H(H2)=-91.80kJ
反応に関与する各物質は与えられた条件でそれぞれ固有のエンタルピー値をもち,反応による物質変化の結果余分となったエンタルピーが熱として放出されることになる。物質はそれぞれの分子で構成され,分子は原子間の化学結合によりつくられるので,化学反応とはこれらの化学結合のあるものが切断され新しい化学結合がつくられる過程とみなすこともできる。化学結合を切断するためにはあるエネルギーを必要とし,逆に化学結合がつくられるときにはあるエネルギーが放出される。これらのエネルギー値を結合エネルギーという。反応熱は,その反応によって生成・切断される化学結合がもつ結合エネルギーの収支を表すものとなる。エネルギー的立場に立てば,弱い結合が切れて強い結合ができる反応ほど起こりやすいと考えられ,事実,常温以下で起こる反応の多くは発熱反応であり,発熱の大きい反応はときに爆発的に進む。吸熱的な反応が起こるのは反応系のエントロピー増大の寄与が大きいためである。たとえば気相での分解反応は,吸熱的であっても,反応の結果物質量の増大によるエントロピーの増大があり,とくに高温ではこの寄与が大きく効くので反応はかなり進む。
化学平衡
反応が進み十分な時間が経過すると反応は見かけ上停止する。この状態は,化学反応式で右に進む反応(正反応)と左に進む反応(逆反応)とがちょうど釣り合ったとき出現し,化学平衡の状態と呼ばれる。定温定圧の条件で化学反応は系のギブズ自由エネルギーが減少する方向に進むので,平衡状態では自由エネルギーは与えられた条件で極小値をとる。反応系の成分iの1 molに割り当てられるギブズ自由エネルギーとして化学ポテンシャルμiを,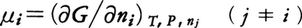 と定義すると,化学反応による自由エネルギー変化は,
と定義すると,化学反応による自由エネルギー変化は,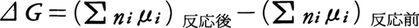 となる。これらの式でniは成分iの物質量である。反応が微小量進むとして,各成分の物質量の変化を,dni=ni(反応後)-ni(反応前)とおくと,上式は,
となる。これらの式でniは成分iの物質量である。反応が微小量進むとして,各成分の物質量の変化を,dni=ni(反応後)-ni(反応前)とおくと,上式は,
dG=Σμidni
となり,化学平衡は自由エネルギー極小の条件dG=0で与えられる。化学反応,
aA+bB+……⇄pP+qQ+……
に対して,化学平衡の条件dG=0から,化学平衡に達したとき濃度比,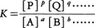
は与えられた条件のもとで一定となることが示される。Kを平衡定数と呼び,この関係を質量作用の法則あるいは化学平衡の法則という。反応の標準自由エネルギー変化⊿G0は平衡定数Kと次の関係,
⊿G0=-RTlnK
がある。ここでRは気体定数,lnは自然対数である。⊿G0が負でその絶対値が大きいほど,反応は進み平衡位置は右へかたよることになる。
反応速度が大きいほど反応は起こりやすいといえるが,反応速度と平衡位置との間には直接関係はない。化学反応が実際に進む経路は一般に非常に複雑であり,化学反応式が示すように簡単ではない。一般に化学反応は,単分子分解および2~3分子の衝突反応の一連の過程の結果として起こる。化学反応を構成するこれらの素過程を素反応と呼び,素反応を用いて書き表した反応経路がその化学反応の反応機構である。通常の化学反応式は,反応の起こる前と完了した後の正味の変化のしかたのみを示すもので,総括反応式とも呼ばれる。反応機構には総括反応式には現れない化学種が含まれるが,それらは反応中間体と呼ばれ,多くは比較的不安定な物質である。反応機構は,広い条件にわたる反応速度の測定・解析,反応中間体の検出・確認などの手法によって総合的に解明される。
化学反応の種類
化学反応の種類は膨大な数にのぼるが,反応機構によっていくつかの型に分類することができる。基本的な化学反応として酸化還元反応と酸塩基反応がある。酸化還元反応は反応体の間で電子e⁻の授受が起こる反応で,電子を与えるものが還元剤,電子を受け取るものが酸化剤である。たとえば反応
3Cu2⁺+2Fe─→3Cu+2Fe3⁺
で,Cu2⁺は還元され(Cu2⁺+2e⁻─→Cu),Feは酸化される(Fe─→Fe3⁺+3e⁻)。酸塩基反応は反応体の間でプロトンH⁺を授受する反応で,プロトンを放出するものが酸,プロトンを受け取るものが塩基である。たとえば反応,
HCl+KOH─→KCl+H2O
では,次の一連の変化,
HCl─→H⁺+Cl⁻,KOH─→K⁺+OH⁻,
H⁺+OH⁻─→H2O
が起こっており,HClは酸,KOHが塩基で,この型の反応を中和反応という。
無機化合物ではイオンの関与する反応が多いが,有機化合物ではイオン反応もラジカル反応も起こる。これは反応に関与する化学結合の開裂のしかたによるもので,化学結合をつくる電子対が一方によって開裂する場合(ホモリシス)はイオン反応となり,電子対が一つずつの電子に分かれ開裂する場合(ヘテロリシス)はラジカル反応となる。不対電子をもつ化学種をフリーラジカルあるいは略してラジカル(遊離基)という。有機反応は形式的に次のように分類することができる。置換反応は原子または原子団の組換えの反応である。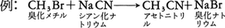
付加反応は注目している原子の結合数が増加する反応である。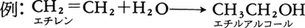
脱離反応は注目している原子の結合数が減少する反応である。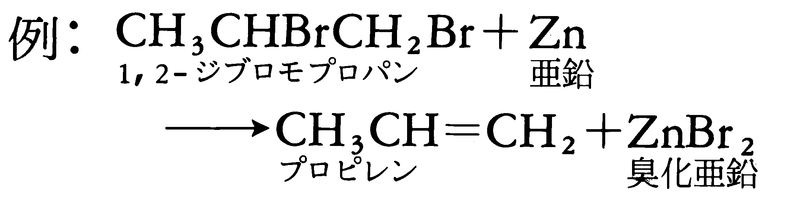
そして,転位・異性化反応は分子内の原子,原子団の結合順序が変化する反応である。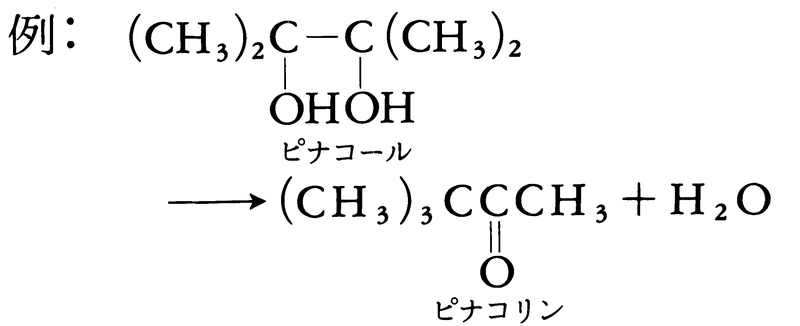
十分に制御された実験室や化学工場の反応器内で行われている化学反応を除いて,自然に起こる化学反応は一般に非常に複雑で,多くの反応が同時にあるいは逐次的に進んでいる。有用な物質を生産し,有害な物質を無害化するために,非常に多くの化学反応が利用されている。
反応速度を大きくしまた特定の反応を選択的に進めるために触媒が利用される。触媒は平衡位置を変えることはないが,反応速度を大きく変化させるので,特定の物質を選択的に効率よく生産するために有効であり,現在特定の反応に選択的に働く触媒の設計もある程度可能となっている。生体内の反応において触媒として働く酵素は非常に選択性の高い触媒であり,酵素の働きにより生体内では複雑な反応がよく制御され組織的に進んでいる。化学反応は化学の最も重要な研究課題の一つであり,これまでに膨大な知見が集積されており,化学工業など多くの関連分野の学術的基礎として役立っている。
→化学平衡 →化学変化 →触媒 →反応速度 →反応熱 →有機化学反応
執筆者:妹尾 学
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「化学反応」の意味・わかりやすい解説
化学反応
かがくはんのう
chemical reaction
ある物質がそれ自身で、あるいは他の物質との相互作用によって、他の物質に変わる現象。この場合、物質を構成している原子どうしの間で組み替えがおこるが、原子の数はこの相互作用の前後で変わらない。化学変化と同義語であるが、とくにその過程に注目するときに化学反応という。この過程を表すのに用いるのが化学反応式である。化学反応は種々の見方から、たとえば熱反応、光化学反応、触媒反応、燃焼反応あるいは反応する種類からするイオン反応、ラジカル反応、核反応、また反応機構からする酸化還元反応、重縮合反応、付加反応、置換反応、連鎖反応、不均化反応などとよばれる種類がある。また有機反応では、反応に加わるもの、反応の種類により、水素化反応、エステル化反応、加水分解反応などとよぶ。
[戸田源治郎・中原勝儼]
化学反応式と化学方程式
反応に関与する変化前の物質(原系の物質、反応物)を左辺に、変化後の物質(生成系の物質、生成物)を右辺にそれぞれ化学式で表し、反応の際の量比(モル比ともいい、最小整数比)を掛けて相互の関係を示したものである。たとえば
2H2+O2=2H2O (1)
H2+Cl2→2HCl (2)
3H2+N2 2NH3 (3)
2NH3 (3)
式(1)のように等号で両辺を結んだものを、とくに化学方程式という。このとき反応に伴う熱量の出入も記すときは、熱化学方程式という。
化学反応は、十分に時間が経過したあとでは平衡に達する。この平衡が原系または生成系にずっと傾いているために、反応条件を変えても、見かけ上その方向にしか反応がおこらないものを不可逆反応(式(2))、平衡で原系の物質も生成系の物質もある量ずつ存在し、原系または生成系の物質を増やせば、平衡が移動する、すなわち、どちらの方向へも反応が進むものを可逆反応という(式(3))。
[戸田源治郎・中原勝儼]
反応速度と反応次数
平衡に向かう反応の速さを反応速度という。この速度は反応するものの濃度(気体の場合は圧力によっても表される)、反応時の温度、触媒の有無、その他の条件によって支配される。反応速度の反応物濃度への依存は反応次数で表される。速度が原系のある物質の濃度に比例する場合を一次、2乗に比例する場合を二次などという。反応物それぞれについての次数の合計を反応の次数という。この次数により反応を一次反応、二次反応などと区別する。
反応速度を規定する反応速度定数kの温度依存性はアレニウスの式で表される。
k=A exp(-Ea/RT)
Eaを活性化エネルギー、Aを頻度因子といい、いずれもその反応に特有の定数である。この式でみるとおり、温度(絶対温度)Tが上昇すれば、速度は急激に大きくなる。通常の反応では室温付近で10℃温度が上がれば、速度は2から4倍くらいになる。水素と酸素との混合物は、室温で混ぜただけでは反応をおこさないが、白金などの触媒を加えるとほとんど瞬時に反応が完結する。
[戸田源治郎・中原勝儼]
反応機構
化学反応のおこる仕組みを反応機構という。反応機構は、反応がおこるときのエネルギー変化(たとえば反応熱)や、反応速度を支配する諸パラメーターを調べることによって解明される。一つの化学反応は、いくつかのそれ以上分けられない反応(素反応という)から成り立つ場合が多い。いいかえれば、化学反応は一つあるいはいくつかの素反応から構成される。反応機構を調べるときには、普通まず反応がどんな素反応から成り立っているかを調べ、そのうえでその素反応のなかでの速さの大小を比べる。素反応のなかでもっとも遅い素反応を律速素反応(または律速反応、律速段階)という。反応するものがすべて気相中にある場合を気相反応、液相にあるものを液相反応、そして固相にあるものを固相反応という。これらの場合はいずれも均一相の反応であるが、反応物が二つの相にまたがって存在する場合を不均一反応という(たとえば、固体の触媒と反応物が気体または液体からなる系の反応は不均一触媒反応という)。反応速度は理論的にいくつかの方法、たとえば、気相反応の衝突説、遷移状態法、絶対反応速度論などによって取り扱われる。
[戸田源治郎・中原勝儼]
『長倉三郎・細矢治夫著『化学反応の機構』(1970・東京化学同人)』▽『福井謙一著『化学反応と電子の軌道』(1976・丸善)』▽『渡辺義一著『化学反応式の作り方』3訂版(1995・黎明書房)』▽『竹内敬人著『化学反応のしくみ』(2000・岩波書店)』▽『戸嶋直樹他編、松本正勝・山田眞二・横澤勉著『有機化学反応』(2005・朝倉書店)』
百科事典マイペディア 「化学反応」の意味・わかりやすい解説
化学反応【かがくはんのう】
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「化学反応」の意味・わかりやすい解説
化学反応
かがくはんのう
chemical reaction
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「化学反応」の解説
化学反応
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

