内科学 第10版 「原発性アルドステロン症」の解説
原発性アルドステロン症(副腎皮質)
原発性アルドステロン症は,副腎皮質から自律性にアルドステロンが過剰に分泌される結果,高血圧症,高アルドステロン症,低レニン血症をきたす疾患である.1955年にConnにより,高血圧症,低カリウム血症,代謝性アルカローシスなどの症状を伴うアルドステロン産生副腎皮質腺腫例(Conn症候群)が報告された.二次性高血圧症のなかで,3~10%を占め,心血管合併症が多い予後不良の高血圧症である.しかし,サブタイプに適した治療を早期に行うことにより,治癒可能な高血圧症である(表12-6-6).
分類
アルドステロンの分泌増加をきたす病態には,原発性アルドステロン症と続発性アルドステロン症(secondary aldosteronism)がある.前者は低レニン血症,後者は高レニン血症を示す【⇨12-6-9)】.また,低レニン低アルドステロン症,高血圧症を呈する鑑別疾患として,アルドステロン以外のミネラルコルチコイド過剰症が存在する(表12-6-6).
原因・病因
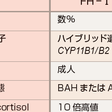
本症の病因としては,アルドステロン産生腺腫(aldosterone-producing adenoma:APA)が40~50%,両側副腎皮質過形成による特発性アルドステロン症(idiopathic hyperaldosteronism:IHA)が50~60%を占める.アルドステロン産生副腎皮質癌によるものはまれである.いずれもアルドステロン合成酵素CYP11B2の過剰発現が原因であるが,最近,APAの一部では,K+チャネルのKCNJ5遺伝子の腺腫部における体細胞変異が病因として示されている.また,遺伝性のサブタイプとして家族性高アルドステロン症(familial hyperaldosteronism:FH)がある(表12-6-7).家族性高アルドステロン症Ⅰ型(FH-I)はグルココルチコイド反応性アルドステロン症(glucocorticoid-remediable aldosteronism:GRA)ともよばれ,ACTHによる調節下にコルチゾール合成酵素(CYP11B1)のプロモーター領域とアルドステロン合成酵素(CYP11B2)とのキメラ遺伝子が異所性に副腎皮質束状層に発現されるために,ACTH依存性にアルドステロンが両側副腎から過剰分泌される.FH-Ⅱは,染色体7p22に関連してAPAやIHAの病型を示し,FHのなかでは一番頻度が高い.FH-Ⅲは,小児例が多く,K+チャネルのKCNJ5遺伝子の胚細胞変異が病因で両側副腎過形成を呈する.
疫学
本症の頻度は,高血圧と低カリウム血症を目安にスクリーニングすると,全高血圧患者の0.5%程度といわれていた.しかし,低カリウム血症を示す例は本症全体の50%以下であることが明らかとなり,早朝の血中アルドステロン濃度高値,レニン活性低値,アルドステロン/レニン比高値を目安にスクリーニングを行うことが推奨されるようになった.そのため高血圧症と診断される患者の3~10%を占めることが判明した.
病理
APAは通常径1 cm以下が多く,なかにはCTスキャンで腫瘍を検出できない数mm程度のAPA(ミクロアデノーマ)もあることから,画像検査のみでは見逃されてしまう. 腺腫は被膜に被包され,その割面は肉眼的に黄金色を呈する.組織学的にはおもに多形性の核と脂質に富み,正常の束状層細胞に類似した形態を示す淡明細胞(clear cell)から構成され,胞巣状または索状の増殖像を示す.腺腫に付随する副腎や対側副腎の球状層細胞には結節性またはびまん性の軽度の過形成(paradoxical hyperplasia)がみられることが多く,これは合併する高血圧症の持続に伴う変化と考えられる. 臨床的には,腺腫と過形成の鑑別が重要である.APAやIHAのアルドステロン産生病変の診断は,免疫組織化学において3β-hydroxysteroid dehydrogenase type 2(HSD3B2,3β-ヒドロキシステロイドデヒドロゲナーゼ2型)陽性および17α-ヒドロキシラーゼ(CYP17)陰性がよい指標として報告されている.また,最近,CYP11B2とCYP11B1に対する特異的抗体の作製が報告され,腺腫組織におけるHSD3B2陽性,CYP17陰性に加えて,CYP11B2陽性によりアルドステロン産生細胞の同定がより確かに行えるようになった.
また,腫瘍付随副腎皮質の球状層細胞は,基本的にはCYP11B2陽性細胞とCYP11B2と-B1のいずれも発現しない細胞(double negative cell)から構成される(層状分化様式)が,一部では,CYP11B2を高発現する被膜下細胞クラスター(aldosterone-producing cell cluster:APCC)を認め,これはAPAの発生母地または前駆段階である可能性がある(斑入り状機能分化様式).
病態生理
本症の病態はアルドステロンの過剰分泌により説明される.アルドステロンは腎臓の皮質集合管細胞に存在するミネラルコルチコイド受容体(MR)に作用して,Naの再吸収を亢進させ,循環血液量が増加する.総末梢血管抵抗は不変または増加するため,血圧は上昇する.体液量の増加が一定レベルに達すると,腎灌流圧の上昇や心房性Na利尿ペプチド(atrial natriuretic peptide:ANP)の増加によって,Naの再吸収が抑制される「エスケープ現象」が起こり,Na貯留が減弱する.一方で循環血液量の増加は二次的に傍糸球体装置のレニン合成と分泌を抑制し,立位や利尿薬によるレニン分泌刺激に対する反応性も低下させる.腎臓では,遠位尿細管でのNa再吸収の亢進に伴い,Kと水素イオンの排出が促進され(Kクリアランスの増加),低カリウム血症(hypokalemia)と代謝性アルカローシス(metabolic alkalosis)をきたす.低カリウム血症は,尿濃縮力の低下(低カリウム性腎症)とそれによる多飲多尿を引き起こす.本症ではMg排泄も促進され,血漿Mg濃度は低下する.細胞内外のKが減少し,Na濃度は増加傾向となり,筋細胞は過分極状態になるため,筋力の低下や四肢麻痺を呈する.さらに,アルカローシスによるイオン化Ca濃度の低下やMgの低下は,テタニーを誘発する.細胞内K濃度の低下はインスリン分泌障害をきたし,本症ではしばしば耐糖能異常や糖尿病を呈する.臨床症状 本症の臨床症状は,アルドステロン過剰に基づく水・Naの貯留による高血圧,低カリウム血症と代謝性アルカローシスが特徴となる.
1)自覚症状:
多くの症例は高血圧が唯一の症状である.高血圧に起因する症状は本態性高血圧症と同様であり,後頭部痛,頭重感,めまい,動悸,不眠症などである.低カリウム血症に関連して,多飲多尿(特に夜間多尿,nocturia),筋力低下がみられる.周期性四肢麻痺(periodic paralysis)は左右対称性で,下肢に強い傾向がある.過労などが誘因となり,安静のみで数時間から1週間くらいで自然に回復することが多い.代謝性アルカローシスによるテタニーは手指や口唇に認められ,有痛性痙攣が下肢に出現することもある.
2)他覚症状:
本症の高血圧は,血圧の変動は比較的少なく,治療抵抗性高血圧である.また食塩感受性高血圧(食塩摂取により血圧上昇をきたし,減塩により血圧が低下する)の代表疾患である.低カリウム血症を伴う例では,低カリウム腎症のために腎臓の尿濃縮力が低下して低張尿となり多尿を認める.体液量は増加するが,前述のエスケープ現象のために浮腫は認めない.ときにテタニーを認め,Trousseau徴候やChvostek徴候を認めることがある.
検査成績
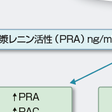
本症においては,血漿アルドステロン濃度の高値と血漿レニン活性(またはレニン濃度)の低値が最も重要である.一般検査では,低カリウム血症,代謝性アルカローシス,およびそれらに伴う変化が特徴的である.血清K濃度は3.5 mEq/L以下の低カリウム血症を呈するが,そのときはKクリアランスの指標のTTKG(transtubular K gradient)が4以上を示すことが多い.減塩食の摂取やアルドステロン分泌量が多くない例では,血清K濃度が正常範囲を示す.しかし,利尿薬処方を行ったり,食塩摂取制限を解除すると低カリウム血症が顕在化する.血清Na濃度は正常上限程度である.代謝性アルカローシスは重要な症候である.血清Ca濃度はほぼ正常であるが,イオン化Caや血清Mg濃度は低下していることが多い.尿は中性~アルカリ性を呈し,軽度の尿蛋白を認めることがある.血清クレアチニン,推算GFR(eGFR)は正常~高値を示す例が多く,重篤な腎機能低下を呈する症例はまれである.空腹時血糖はほとんどの症例で正常範囲であるが,低カリウム血症や高アルドステロン症による膵β細胞への直接作用により,インスリン分泌が抑制されるため,糖負荷試験では約半数が耐糖能異常を示す.本症では,高血圧症に加えて肥満,耐糖能異常,脂質異常症などのメタボリック症候群を呈する割合が多い.
診断
1)スクリーニング:
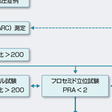
a)対象:スクリーニングの対象として,日本内分泌学会のガイドラインでは,高血圧全例と記載されている(図12-6-16).一方,日本高血圧学会やアメリカ内分泌学会のガイドラインでは,高頻度群として,①低カリウム血症を合併する高血圧(利尿薬誘発性を含む),②Ⅱ度以上の高血圧(収縮器血圧>160または拡張期血圧>100 mmHg),③降圧薬が3剤以上必要となる治療抵抗性高血圧,④副腎偶発腫瘍を伴う高血圧をあげている.さらに,⑤若年発症の高血圧の家族歴または40歳以下で脳血管障害などの臓器障害合併例も含めており,これは家族性高アルドステロン症Ⅰ型(CYP11B1/B2キメラ遺伝子が病因)を想定している.また,⑥PA患者の第一度近親者の高血圧は,家族性高アルドステロン症Ⅱ型(FH-Ⅱ)を想定しており,FH-Iよりははるかに高頻度である(表12-6-8).
b)スクリーニングの指標:PAのスクリーニングは,アルドステロン高値よりも,レニン抑制をおもに検出するステップである.早朝の採血で,血漿アルドステロン濃度(PAC)高値,血漿レニン活性(PRA)(または活性レニン濃度(ARC))低値を目安に行うのが有効であり,アルドステロン/レニン比( aldosterone-to-renin ratio:ARR)>200をとりあげている(図12-6-16).ARRは,分母のPRAに大きく影響されるために,低レニン低アルドステロン症でもARR>200を示す症例があり注意が必要であり,ARR>200にPAC>150pg/mLを加えることで偽陽性が減る.
c)降圧薬の影響:スクリーニングがおもにレニンの値に依存するために,内服中の降圧薬の影響で偽陰性や偽陽性となることがあるので注意が必要である.ガイドラインでは,降圧薬などの影響を受けずにスクリーニングを行うためには,Ca拮抗薬やα遮断薬に変更して2週間以降にARRスクリーニングを行うことを推奨している.降圧薬の種類やNa,Kの状態,加齢,腎障害,妊娠などによるPRA,PACへの影響をよく知っていることが重要である(表12-6-9).アンジオテンシン受容体拮抗薬(ARB)や利尿薬を内服中では,PRAが著明に増加するが,これらを内服中でPRA<1.0 ng/mL/時の低レニンを示すときは,PAの可能性が非常に高いことになる.一方,β遮断薬の内服中はPRAが低下するため,ARPが偽高値を示すことがある.
2)確定診断:
日本のガイドラインでは,カプトプリル負荷試験,フロセミド立位負荷試験,生理食塩水試験,経口食塩負荷試験などを推奨している(図12-6-16).米国内分泌学会のガイドラインでは,フルドロコルチゾン抑制試験もとりあげている.ほとんどの内分泌負荷試験は,アルドステロン抑制試験である.容量負荷によるアルドステロン抑制試験を行う際には,低カリウム血症があるときはまず補正してから行うことが重要である.低カリウム血症はアルドステロン分泌を抑制するために,補正せずにアルドステロン抑制試験を行うと,偽陰性となることがある.また,低カリウム血症がある状態で容量負荷を行うと,腎臓の皮質集合管レベルでNa再吸収,K分泌の交換が促進されるために,低カリウム血症が増悪する危険がある.
臨床的には,アルドステロン産生腺腫と特発性アルドステロン症の鑑別は重要である.特発性アルドステロン症では,腺腫と比べると,アルドステロン分泌量が少なく,血漿レニン活性もやや高値を示し,血清カリウム濃度も正常の例が多い.また,腺腫では一般的にアルドステロン分泌はACTH依存性が多く,両側副腎過形成ではレニン-アンジオテンシン系依存性が多いとされており,腺腫では,フロセミド立位負荷試験において血漿アルドステロン濃度が低下するのが典型的な反応であるが,血漿アルドステロン濃度が上昇するレニン反応性アルドステロン産生腺腫(renin-responsive aldosteronoma)もあり,負荷試験の結果だけから病型鑑別を行うのは限界があり,後述の副腎静脈サンプリングが必要である.
a)カプトプリル負荷試験:本試験は,アンジオテンシンⅠをⅡに変換する酵素(angiotensin converting enzyme:ACE)の阻害薬であるカプトプリル50mgを経口投与し,投与90分後の血漿レニン活性と血漿アルドステロン濃度を,基礎値と比較する.健常者や本態性高血圧患者では,アンジオテンシンⅡの減少により,アルドステロン分泌は低下する.同時に,アンジオテンシンⅡによるレニン分泌抑制効果も減弱するため,血漿レニン活性は上昇する.90分後の血漿アルドステロン濃度/レニン活性比≧200または血漿アルドステロン濃度の減少<前値の30%のときに,本症と判定する.
b)フロセミド立位負荷試験:本試験は,ループ利尿薬のフロセミド40 mgを静脈内投与し,2時間立位後に血漿アルドステロン濃度と血漿レニン活性を,基礎値と比較する.健常者や本態性高血圧患者では,レニン活性およびアルドステロン濃度ともに著明に増加する.本症では,高アルドステロン症によりレニン分泌が慢性的に抑制されているため,フロセミド投与および立位負荷によりレニン分泌を刺激しても抑制が続き,2時間後のレニン活性<2 ng/mL/時のときに本症と判定する.
c)生理食塩水試験:本試験は,生理食塩水2Lを4時間かけて点滴静注し,4時間後の血漿アルドステロン濃度を基礎値と比較する.健常者や本態性高血圧患者では,容量負荷によりレニン分泌が抑制され,アルドステロン濃度も抑制される.4時間後の血漿アルドステロン濃度≧60pg/mLのときに本症と判定する.
d)経口食塩負荷試験:本試験は,食塩負荷(NaCl 10~12 g/日を3日間摂取)後の24時間尿中アルドステロンとナトリウムを測定する.健常者や本態性高血圧患者では,c)
と同様の原理でレニン分泌が抑制され,アルドステロン濃度も抑制される.食塩負荷3日後の24時間尿中アルドステロン排泄>8 μg (食塩10 g/日摂取すると,1g=17 mEqであることから,24時間尿中Na排泄>170 mEqとなる)のときに,本症と判定する.
e)フルドロコルチゾン抑制試験:本試験は,ミネラルコルチコイドのフルドロコルチゾン0.4mg,KCl,NaClを3日間投与して,4日目の朝の血漿アルドステロン濃度を測定する.健常者や本態性高血圧患者では,c)
と同様の原理でレニン分泌,アルドステロン濃度ともに抑制される.血漿アルドステロン濃度>60pg/mLのときに本症と判定する.
f)迅速ACTH負荷試験:本試験は,ACTH(1-24)を0.25 mg静注し,0,30,60,90,120分後の血漿アルドステロン濃度とコルチゾール濃度を測定する.アルドステロン産生腺腫では,アルドステロン分泌がACTH依存性の例が多いため,アルドステロン濃度の頂値/コルチゾール濃度(同じ時間)比>8~10または,血漿アルドステロン濃度(90分後)>380 pg/mLを示す例が多い.
g)サブクリニカルCushing症候群の合併の検索:アルドステロン産生腺腫の場合,腫瘍が大きくなると(通常は径3 cm以上),アルドステロンと同時にコルチゾールも自律的に分泌する症例(サブクリニカルCushing症候群)が多い(図12-6-17C).したがって,夜間血清コルチゾール濃度>5 μg/dLやデキサメタゾン1 mg抑制試験(一晩法)で翌朝の血清コルチゾール濃度>3 μg/dLを示すときはサブクリニカルCushing症候群の合併を疑う.合併例では,対側副腎のコルチゾール分泌が抑制されていることから,術後に一定期間,コルチゾール補充療法を行わないと副腎不全をきたすことがある.
3)局在診断:
副腎腫瘍の局在診断として,腹部CTあるいはMRIは必ず撮影する.本症の腺腫は径1 cm以内のミクロアデノーマが多い.アルドステロン産生腺腫が検出される場合は,非造影CTで,辺縁整,内部均一,CT値<10 HU (Hounsfield unit)の腫瘍が多い(図12-6-17A).腺腫は脂肪含量が多いため,CT値<10HUは特異的所見となる.アルドステロン産生腺腫と特発性アルドステロン症をCTで鑑別することは困難であり,正診率は50%以下である.特発性アルドステロン症では,両側副腎の腫大を認める例(図12-6-17B)や両側副腎とも正常など多様である.本症の画像検査としてMRIはCTを超える意義はない.
アルドステロン産生病変の機能的局在診断としては,副腎静脈サンプリング(adrenal venous sampling:AVS)がゴールドスタンダードである.左右の大腿静脈からカテーテルを挿入して,左右の副腎静脈および下大静脈(末梢)にて採血を行い,アルドステロンとコルチゾール濃度を測定する.また,引き続き,ACTHを点滴静注または静注後に同様の採血を行うことも有用である.AVSは技術的に難しく,特に右副腎静脈への挿入は放射線科医の経験により成功率が左右される.AVSの判定は,カテーテルが左右の副腎静脈に確実に挿入されていることが前提であり,カテーテル挿入の成功は,副腎静脈コルチゾール/IVCコルチゾール比>3(基礎値)および>10(ACTH負荷)により確認される(表12-6-10).アルドステロン過剰分泌の局在は,副腎静脈のアルドステロン/コルチゾール比の高値側÷低値側の比(lateralized ratio:LR)>2.6~4.0のときに高値側の片側病変と判定される.また,アルドステロン/コルチゾール比の低値側÷IVCの比(contralateral ratio:CR)<1のときは,低値側が健常副腎と判定される.また,ACTH負荷後の副腎静脈アルドステロン濃度>14000 pg/mLのときは過剰分泌ありと判定する指標もある(表12-6-10).
シンチグラフィは腫瘍の機能を反映する診断法としてすぐれているが,131I-アドステロールシンチグラフィは,コルチゾールとアルドステロン合成の総和に比例して集積する.コルチゾールの産生量はアルドステロンの産生量の100~1000倍であるので,通常の131I-アドステロールシンチグラフィはコルチゾールの産生能をおもに示す.したがって,アルドステロン合成能を画像化するために,アイソトープを静注する3日前からデキサメタゾン2mg/日を投与して,内因性ACTHを抑制し,コルチゾール合成を完全に抑制したうえでシンチグラフィを行う必要がある(デキサメタゾン抑制アドステロールシンチグラフィ)(図12-6-18).しかし,本検査は原発性アルドステロン症の局在診断としての正診率は高くないため,診療ガイドラインには記載されていない.AVSが成功しなかった例やAVSが施行できない例では,行う価値がある.
鑑別・診断
本症では,高血圧と低カリウム血症を呈する疾患が鑑別の対象となる(図12-6-19).
1)低レニン性本態性高血圧症(hyporeninemic essential hypertension):
頻度が高いが,低カリウム血症の合併はまれで,血漿アルドステロン/レニン活性比は通常200未満を示す.副腎偶発腫瘍と本態性高血圧症の合併は年齢とともに頻度が増加するので,原発性アルドステロン症の除外が必要となる.
2)原発性アルドステロン症:
前述のように,アルドステロン産生腺腫と特発性アルドステロン症の鑑別は治療方針が異なることから重要である.
a)アルドステロン産生腺腫(aldosterone-producing adenoma:APA):原発性アルドステロン症のスクリーニング陽性で,確定診断された症例で,AVSにて片側病変と判定された場合,手術適応となる.
b)特発性アルドステロン症(idiopathic hyperaldo-steronism:IHA):原発性アルドステロン症と確定診断された例で,AVSにて両側病変と判定された例や,判定困難例,AVS失敗例,またはAVS未施行例は臨床的に特発性アルドステロン症と同様に薬物治療の適応となる.
c) 家族性高アルドステロン症(表12-6-7)(familial hyperaldosteronism:FH):グルココルチコイド反応性アルドステロン症(FH-I)は,副腎に明らかな形態的異常はなく,常染色体優性遺伝を示すまれな疾患である.本症は少量のデキサメタゾンの連続投与により,高血圧,血漿アルドステロン濃度高値が正常化する特徴がある.本症の病因は前述のように,CYP11B1/CYP11B2キメラ遺伝子が束状層に異所性に発現し,束状層で産生されるコルチゾール→18-ヒドロキシコルチゾール→18-オキソコルチゾールが著明に増加することから本症の生化学的診断に有用である.FH-Ⅱは染色体7p22と関連して,病型はアルドステロン産生腺腫または特発性アルドステロン症を示し,やはり18-オキソコルチゾールの軽度高値を示す.FH-Ⅲは最近明らかにされたサブタイプで,KCNJ5遺伝子の胚細胞変異により両側副腎の著明な腫大を認め,18-オキソコルチゾールは1000倍以上の高値を示す.FH-Ⅲは両側副腎摘出術の適応となる.
3)アルドステロン関連高血圧・ミネラルコルチコイド受容体関連高血圧:
高血圧症でアルドステロン/レニン比が高値であるが,カプトプリル負荷試験などの負荷試験の結果,原発性アルドステロン症と確定診断されない例も多数あり,アルドステロン関連高血圧(aldosterone-associated hypertension)とよばれる.これは,原発性アルドステロン症とは分類上異なるが,同様に治療抵抗性高血圧を呈する.
また,血漿アルドステロン濃度は正常範囲であるが,ミネラルコルチコイド受容体が病的に活性化されている高血圧として,肥満,糖尿病,睡眠時無呼吸症候群,慢性腎臓病などがある.これらの病態では,多様な機序で組織のミネラルコルチコイド受容体が活性化されており,ミネラルコルチコイド受容体関連高血圧(mineralocorticoid receptor-associated hypertension)とよばれる.本高血圧も治療抵抗性高血圧をきたし,ミネラルコルチコイド受容体拮抗薬によく反応する.
4)低レニン低アルドステロン症を呈する高血圧症(図12-6-19):
a)副腎皮質ホルモン産生異常症:Cushing症候群,異所性ACTH症候群,DOC(11-deoxycorticosterone,11-デオキシコルチコステロン)産生腫瘍,先天性副腎過形成(11β-ヒドロキシラーゼ欠損症,17α-ヒドロキシラーゼ欠損症)などでは,コルチゾールやDOCが高値となり,MR活性化を起こすために低レニン,低アルドステロン症を示す.
b)偽アルドステロン症(pseudohy-peraldosteronism):漢方薬などに含まれる甘草の成分のグリチルリチンは,コルチゾールをコルチゾンに不活性化する11β-ヒドロキシステロイドデヒドロゲナーゼ(11β-HSD2)を阻害する.コルチゾールはMRに親和性をもつが,コルチゾンはもたない.腎尿細管には11β-HSD2が存在し,低濃度のアルドステロンが腎尿細管のMRに特異的に結合する.したがって,グルチルリチンにより過剰になったコルチゾールは腎尿細管のMRと結合して活性化するため,ネガティブフィードバックにより低レニン,低アルドステロン症を呈する.
c)Liddle症候群:高血圧症,低カリウム血症,代謝性アルカローシス,低レニン,低アルドステロン症を認める常染色体優性遺伝疾患である.腎尿細管のアミロライド感受性Naチャネル(epithelial Na channel:ENaC)のα,β,γの3種類のサブユニットのうち,βあるいはγサブユニットの遺伝子変異のため,ENaCの蛋白分解が妨げられENaCの発現量が亢進することが病因であり,アルドステロンとは無関係にNa再吸収が亢進し,低レニン低アルドステロン症を示す.本症は,MR拮抗薬のスピロノラクトンは無効で,ENaC阻害薬のトリアムテレンやアミロライドが有効である.
d)続発性アルドステロン症:
レニン-アンジオテンシン系の亢進により二次的にアルドステロン分泌が増加する病態である.血漿レニン活性の高値により,原発性アルドステロン症と鑑別される.合併症 合併症の程度は高血圧の重症度と罹病期間に依存する.従来は本症による臓器障害は低レニン性高血圧であることから比較的軽いとされていたが,近年アルドステロンの心血管組織に対する直接作用が明らかにされ,同程度にコントロールされた本態性高血圧症と比べると,脳血管疾患,虚血性心疾患,心肥大,不整脈,慢性腎臓病,動脈硬化性疾患などの合併症が約3~6倍高頻度である.したがって,降圧療法のみでは不十分であり,アルドステロン作用の阻害を十分に行う必要がある.治療・予後 PAと確定診断されたときは,手術を希望する場合は局在診断まで行い,片側副腎病変か否かを確定し,副腎摘出術を行う.また,局在診断の結果,両側副腎病変と判定された場合や全身状態から手術不能例では,薬物療法を行う.両治療とも高血圧や低カリウム血症の是正に有効である.
1)外科治療:
副腎静脈サンプリングの結果,アルドステロン産生腺腫または原発性副腎過形成による片側性病変と考えられる場合は,腹腔鏡下片側副腎摘出術(laparoscopic unilateral adrenalectomy)が原則である.一方,両側性病変と考えられるときは,特発性アルドステロン症または両側性アルドステロン産生腺腫が考えられるが,この鑑別は現時点では困難であることから,臨床的に特発性アルドステロン症と考えられ,手術適応はなく,薬物治療を行う.したがって,アルドステロン産生腺腫と特発性アルドステロン症の鑑別が重要である.外科治療は治癒可能な唯一の治療法である.
術後に低カリウム血症や高アルドステロン症は速やかに改善するが,低レニン血症はしばらく遷延する例が多い.高血圧は,1/3の症例で降圧薬が不要となり治癒可能であるが,残りの2/3の症例では,降圧薬の数は減るが一定量が必要となる.この違いは,術前の罹病期間や動脈硬化症の進行に依存する.術前から,ミネラルコルチコイド受容体拮抗薬スピロノラクトンやエプレレノンによる治療を開始して,血圧や電解質の改善を行い,術後の降圧の程度を予想することは重要である.
2)薬物治療:
術前治療として,また,外科的治療が困難な特発性アルドステロン症に対して薬物治療を行う.薬物療法はミネラルコルチコイド受容体(MR)拮抗薬のスピロノラクトンかエプレレノンが中心となり,その使い分けには注意が必要である.まず,両者とも血中K濃度が上昇するため,慢性腎臓病でeGFR<50 mL/分/1.73 m2の例では血清カリウム濃度をモニターしながら慎重に投与する必要がある.また,スピロノラクトンは,女性化乳房,勃起障害,月経異常などの内分泌的副作用を認めるが,エプレレノンではほとんどなく,中高年男性に適する.一方,エプレレノンの短所は,2型糖尿病で微量アルブミン尿を伴う例や,カリウム製剤の併用が必要となる例では原則禁忌であり使用できない.また,エプレレノンのMR拮抗作用はスピロノラクトンの約50~70%と力価が弱い. 原発性アルドステロン症は治療抵抗性高血圧が多く,MR拮抗薬単独でコントロールできない例が多く,Ca拮抗薬の併用が非常に有用である.現時点では,外科治療と薬物治療の優劣は不明であり,同等であったとの報告はある. また,遺伝性の家族性高アルドステロン症Ⅰ型(グルココルチコイド反応性アルドステロン症)に対しては,グルココルチコイドのデキサメタゾンやスピロノラクトンが有効である.
治療開始後,治療前と比べて多くの例でeGFRが低下する.これは,本症では糸球体過剰濾過によりeGFRが実際の腎機能より高値を示すためで,手術や薬物治療によりアルドステロン作用が低下すると,血行動態の低下によりeGFRが低下して慢性腎臓病となる例が多い(仮面慢性腎臓病,masked chronic kidney disease).しかし,治療によりほとんどの例で蛋白尿の減少を伴い,長期的には腎機能の予後を改善する.[柴田洋孝・伊藤 裕]
■文献
Funder JW, Carey RM, et al: Case detection, deaginosis, and treatment of patients with primary aldosteronism; an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab, 93: 3266-3281, 2008.
Shibata H, Itoh H: Mineralocorticoid receptor-associated hypertension and its organ damage: clinical relevance for resistant hypertension. Am J Hypertens, 25: 514-523, 2012.
Nishikawa T, Omura M, et al: Guidelines for the diagnosis and treatment of primary aldosteronism – The Japan Endocrine Society 2009 –. Endocr J, 58: 711-721, 2011.
原発性アルドステロン症(代謝・内分泌疾患に伴う神経障害)
概念
多くはアルドステロン産生腺腫,その他副腎癌,特発性副腎結節性過形成により過剰にアルドステロンが分泌された状態.本症による神経症状は高血圧症に合併する脳内出血や高血圧性脳症,低カリウム血症に伴う周期性四肢麻痺や低カリウム性ミオパチー,テタニーに分類される.
臨床症状
脳出血は別項を参照【⇨15-5-8)】.高血圧性脳症は通常発症時の拡張期血圧が120 mmHgをこえており,頭痛,悪心,嘔吐といった頭蓋内圧亢進症状,痙攣,意識障害などを呈するが,局所症状はない.低カリウム性ミオパチーでは近位筋の脱力をきたす.
診断
高血圧,低カリウム血症,血漿アルドステロンの高値,血漿レニン活性低値を認める.甘草を含む漢方薬の使用で偽性アルドステロン症となり同様の筋症状を示すことがある.
治療
腺腫や癌なら外科的切除術が基本であるが,手術不能例ではスピロノラクトン,Ca拮抗薬,アンジオテンシン受容体拮抗薬などの降圧剤を使用する.[中里雅光]
出典 内科学 第10版内科学 第10版について 情報