翻訳|enzyme
精選版 日本国語大辞典 「酵素」の意味・読み・例文・類語
こう‐そカウ‥【酵素】
- 〘 名詞 〙 生体内でつくられ、生体の営む化学反応を触媒するたんぱく質を中心とした高分子化合物。生体内のほとんどの化学反応にあずかっているので生命活動と密接な関係がある。種々の分類法があるが、生理作用に基づくと、消化・糖化・発酵・呼吸・解糖などの各酵素類に分けられる。細菌や酵母の酵素を利用して酒、みそなどの食品製造に使われるほか、生体内から抽出して消化剤などの医薬品にも用いられる。〔稿本化学語彙(1900)〕
日本大百科全書(ニッポニカ) 「酵素」の意味・わかりやすい解説
酵素
こうそ
enzyme
生物がつくりだす触媒作用をもつタンパク質で、生体触媒ともいう。生体内で行われるほとんどの化学反応は、酵素の触媒によって初めて進行するので、生命にとってはなくてはならないものである。
[笠井献一]
研究史
生物は、試験管内ではとうていできないような複雑な化学反応をいとも容易に行っている。このような能力は生物だけに宿っている神秘的な生命力によるものと昔は考えられていたが、多くの研究によって酵素という物質の力によることがわかってきた。
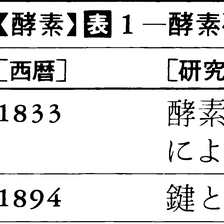
1752年にフランスのR・F・レオミュールは、鳥の胃液が肉を溶かすのをみつけ、生体内の反応が生体外でもおこりうることを示した。1833年にJ・F・ペルソーとA・ペイアンが、麦芽からデンプンを分解する成分を取り出し、ジアスターゼと名づけた。これが酵素を物質としてとらえた最初である。やがて胃液からはペプシンが、その他の臓器からもいろいろな消化酵素がみつけられた。1878年にドイツの生理学者キューネWilhelm Kühne(1837―1900)は、このように生体外に取り出せる酵素をエンチームEnzym(ドイツ語)と名づけた。消化酵素以外では、1894年にフランスの生化学者G・E・ベルトランが酸化酵素を、1898年にE・ブフナーがアルコール発酵を行う酵素(群)をみつけ、生物の行う化学反応のほとんどに酵素が関係していると信じられるようになった。1926年にJ・B・サムナーがウレアーゼの結晶化に成功し、それがタンパク質であることを確認した。
第二次世界大戦以後、酵素の構造研究は飛躍的に進み、1963年にアメリカの生化学者W・H・スタインとS・ムーアらがウシ膵臓(すいぞう)のリボヌクレアーゼのアミノ酸配列を完全に決定し、1965年にはイギリスのフィリップスDavid Chilton Phillips(1924―1999)らが、X線解析法によって卵白リゾチームの立体構造を明らかにした。また1980年(昭和55)には当時の京都大学薬学部教授の矢島治明(やじまはるあき)と助教授藤井信孝(ふじいのぶたか)(1950― )が、ウシ膵臓リボヌクレアーゼの完全化学合成に成功した。
[笠井献一]
種類
細菌のような簡単な生物でさえも1000種類以上の酵素を必要とするから、全生物界に存在する酵素の種類は膨大なものとなる。これを合理的に分類整理するために1961年、国際生化学連合(現在は国際生化学・分子生物学連合)が分類命名法を提案した。これは分類の基礎を、酵素が触媒する化学反応の型に置いている。大まかに六つの群に分け、それがさらに細分されている()。研究が進むにつれて、予想もしなかったような作用をもつ酵素がみつかったりするので、現在でもときどき修正される。
[笠井献一]
化学的・物理的性質
酵素はごく一部の例外を除いて、単純タンパク質または複合タンパク質の高分子であるから、化学的・物理的性質はタンパク質の性質がそのまま当てはめられる。分子量は小さいもので約1万(アミノ酸として約100個)、大きいものでは10万(アミノ酸として約1000個)以上のものもあるが、数万程度のものがもっとも多い。ある種の酵素では、タンパク質以外の低分子化合物が存在しないと触媒作用を行えないものがある。このような低分子物質を補酵素または補欠分子族という。例外的ではあるが、ある種のRNA(リボ核酸)が触媒作用をもつことが発見されており、これらはリボザイム(リボはRNA、ザイムはエンザイムの語尾)とよばれている。
[笠井献一]
分離と精製
酵素を得るには生物あるいは生物の生産物を原料とする。分離精製法はタンパク質の場合と本質的には変わらないが、酵素はとくに不安定なため、低温、中性の水素イオン濃度(pH)で取り扱うなど、細心の注意を払わなければならない。高温、強い酸やアルカリ、有機溶媒などにさらされると酵素タンパク質が変性し、触媒能力が失われて元に戻らなくなる危険性が大きい。最近は、酵素が基質に似た物質によく結合することを利用したアフィニティ(親和力)クロマトグラフィー法が発達してきたので、短時間で能率よく純化できるようになった。今日では純化されている酵素は多数に上り、さまざまな分野で役だっている。
[笠井献一]
酵素の生合成
生物の体内では、酵素も普通のタンパク質とまったく同じやり方で合成されている。その生物のもっているすべての酵素のアミノ酸配列は、遺伝子であるDNA(デオキシリボ核酸)に記録されており、必要なときに必要な酵素が合成されるよう巧みに制御されている。
[笠井献一]
酵素の役割
生物が生きていくためには、無数の化学反応を一瞬の休みもなく続けていなければならない。ところが化学反応というものは、生物の細胞が生きている環境、すなわち40℃以下の温度、水という溶媒、中性のpHなど、いわゆる穏やかな条件下では、非常に進行しにくいものである。生物体内で行われている化学反応のうちのかなり単純なものでさえ、試験管内でまねるのはやさしくない。たとえば、胃の中で毎日行われているタンパク質の消化(加水分解)を酵素なしで試験管内で行わせるのはたいへんである。胃液に含まれるよりも100倍も濃い塩酸の中で、一昼夜も100℃くらいに熱し続けなくてはならない。ましてや生体成分の合成のように複雑な化学反応を試験管内で完璧(かんぺき)にまねることなど不可能である。ところが生物では、無数の複雑な化学反応が互いに組み合わさりながら、みごとな秩序をもって、すばやく進行している。このようなことができるのは、一つ一つの化学反応が、それぞれきちんと定められた酵素によって導かれているからである。
酵素の触媒作用を受ける物質を基質、その反応によってつくりだされる物質を生成物とよぶ。酵素は化学反応の手助けをするが、自分自身は変化しないので、何回でも繰り返して働くことができる。したがって基質よりはるかに少ない量さえあればよい。基質が生成物に変わるという化学反応がおこるためには、基質がいったん変化途中の不安定な状態にならなければならない。この状態に到達するにはエネルギーが必要であり、それを活性化エネルギーという。この活性化に必要なエネルギーが大きいほど反応はおこりにくいことになる。酵素は、ほんの小さなエネルギーさえあれば、基質がこの中間状態に到達できるよう手助けする。これを活性化エネルギーを低下させるという。たとえていえば、基質から生成物へと変わるには、高いエネルギーの山を越えていかねばならないところを、酵素はトンネルをつくってすばやく向こう側へ行かせるのである。これによって化学反応は短い時間で平衡状態に到達できる。この性質は一般の触媒と同じであって、基質と生成物の量が平衡状態に到達したら、それ以上反応を進めることはできないが、酵素にはそのほかにも以下に述べるようなさまざまな優れた特性があり、酵素に匹敵するような触媒はほかにはなく、人工的につくられてもいない。
[笠井献一]
酵素の特色
(1)酵素は効率がよい。たとえばカタラーゼがあれば、1分間に500万分子の過酸化水素が分解される。鉄の錯塩のあるものもこの反応を触媒できるが、分解速度は1分間に10万分子くらいである。
(2)特異的である。酵素が触媒しうる化学反応は厳重に決められている。たとえばキモトリプシン、トリプシンなどは、タンパク質の加水分解反応なら触媒するが、デンプンや脂肪の加水分解はまったく触媒しない。タンパク質の加水分解についても、キモトリプシンとトリプシンでは役割が違い、分解されるペプチド結合が異なっている。またこれらの酵素はL型のアミノ酸からなるペプチド結合だけを分解し、ラセミ化のような副反応もおこさない。このように酵素の基質、生成物、反応形式などが厳重に決まっているため、細胞内では複雑な反応が間違いなく、整然と行われるのである。これは酵素分子が、決まった基質とだけ結合する性質をもっていて、その物質だけが触媒作用を受けられるからである。
(3)酵素の作用は調節できる。酵素の触媒能力は、いろいろの条件で強められたり弱められたりする。たとえば、生成物が十分につくられ、もはやそれ以上必要なくなると、酵素の能力が抑えられる。逆にある物質が欠乏したときには、ホルモンなどの作用により必要な酵素が活性化され、その物質を速やかに合成する。
(4)至適温度(最適温度)をもつ。酵素に触媒される反応でも温度が上がれば反応は速くなるが、普通は40℃を超えるあたりから、むしろ反応が遅くなる。これは、酵素がタンパク質であり、熱に弱く、立体構造が壊れて、酵素としての能力が失われてしまうからである。反応がもっとも速くなる温度を、その酵素の至適温度という。
(5)至適pH(最適pH)をもつ。酵素の作用の強さはpHによって変わる。もっとも作用の強いpHを至適pHという。普通は7付近の中性である。しかし胃の中のように強い酸性の環境下で働く消化酵素ペプシンは、至適pHが2くらいであり、その目的によくかなっている。
[笠井献一]
酵素の作用機構
以上のような酵素の特色は、すべてタンパク質分子としての酵素の構造に由来している。今日ではかなりの酵素の立体構造がわかっているので、どのようにして触媒作用が行われるのか、かなり詳しく推定できるようになった。酵素分子には、さまざまな役割を受け持つ部位がある。そのうちでいちばん重要なのは活性部位である。これのおもな役割は二つある。一つは基質を正しく抑え込むこと(特異的基質結合)、もう一つは化学反応の進行を手助けすること(触媒作用)である。これらが実際にどのように行われるかは、酵素の種類によって千差万別であるが、例としてタンパク質加水分解酵素であるキモトリプシンについて説明しよう。
キモトリプシンはアミノ酸が二百数十個つながった分子量約2万5000のタンパク質である。大ざっぱな形は球に近い。分子の一部(の正面中央)にくぼみがあり、ここが活性中心である。これをわかりやすいように図式化すると、基質結合部位と触媒部位に分けることができる()。この酵素は、基質となるタンパク質中にフェニルアラニン、チロシン、トリプトファン(いずれも側鎖に芳香環を含む)がある場合に、そのカルボキシ(カルボキシル)側のペプチド結合を加水分解する。したがって芳香族アミノ酸に特異的である。その理由は、活性部位のなかでさらに深く彫り込まれた洞穴状の基質結合部位があり、そこにこれらのアミノ酸の芳香環がぴったりはまるからである。この洞窟を基質結合ポケットという。したがって基質となるタンパク質は芳香族アミノ酸の所で活性部位に固定される。これら以外のアミノ酸の所では固定されない。固定されて初めて触媒作用を受けられるようになる。加水分解()はペプチド結合R1-CO-NH-R2の間に水H2Oが1分子入ってR1-COOHとH2N-R2のように切り離す反応であるが、水分子が直接にこの結合を攻撃しても手に負えない。そこで触媒部位が手助けする。ここで主役を演じるのが、触媒部位にある特別なセリンである。セリンの側鎖には水と構造の似たヒドロキシ基(OH基)があるが、この特別なセリンのヒドロキシ基は水よりも結合を切断する力がはるかに強い。これがCO-NH結合を攻撃してまず切り離し、そのあとで水分子に手渡すのである。触媒作用を完了した後は、酵素自体にはなんの変化も残らないので、最終結果だけをみれば、水がペプチド結合を切ったことになるが、酵素の助けがなければ腸内のような穏やかな環境ではおこりえなかったことである。キモトリプシンによく似たタンパク質にトリプシンがある。この二つの酵素は立体構造もそっくりであるが、トリプシンは基質タンパク質のなかで、リジンやアルギニンのある位置に限って切断する。基質結合ポケットの形が、リジンやアルギニンのように側鎖に正電荷をもつアミノ酸をぴったりとはめ込むからである。このように酵素の特異性は、おもに基質結合部位の性質から理解することができる。
[笠井献一]
酵素の利用
さまざまな分野で、生物から取り出した酵素が利用されている。原料としては、動物、植物も使われるが、細菌やカビなどの微生物が、短時間で増やすことができ、目的酵素をたくさんつくる品種(菌株)を得やすいなど、有利な点が多い。最近では、遺伝子工学によって、人間などの酵素を微生物に生産させることも行われている。酵素の利用例をいくつかあげる。
(1)有用有機物質の生産。有機合成技術が今日のように進歩しても、生物に由来するものを使うほうが圧倒的に有利な場合が多い。そこで生物に材料を求め、それを酵素で目的物につくりかえることは盛んである。たとえばデンプンはグルコース(ブドウ糖)の重合したものであるから、加水分解さえすればグルコースが得られる。これには酸やアルカリを使うより、微生物からとれるデンプン加水分解酵素を使うほうがはるかに有利なので、工業的に行われている。またアミノ酸などは、化学合成では目的とするL体以外に、不必要な光学異性体であるD体までできてしまうが、それを除去するのにも酵素が利用されている。チーズをつくるには牛乳を凝固させるのが第一段階で、その際子ウシの胃に含まれるキモシン(レンニン)という酵素が使われるが、これには供給に限りがある。そこで最近は、同じ作用をする酵素を微生物から得て使っている。
(2)医薬品として。病気の治療のために欠乏している酵素を与えたり、殺菌作用がある酵素を与えると効果がある。心筋梗塞(こうそく)や脳血栓は、血管内に血栓ができて詰まるのが原因であるが、ウロキナーゼというタンパク質分解酵素を注射すると治療できる。これは、血液中にもともと存在していて、血栓を溶かすのが本来の役割であるプラスミンという酵素の働きを強めるのである。炎症を鎮めるために、病原菌を溶かすリゾチーム、膿(うみ)などを分解して除去するタンパク質分解酵素なども使われている。消化不良の治療には、デンプン分解酵素であるタカジアスターゼ、いろいろな消化酵素の混ざったパンクレアチンなどを飲ませると効果がある。
(3)基礎科学の研究手段として。タンパク質、核酸、多糖など、生物にとって重要な役割を果たしている高分子物質の構造を調べるには、酵素はなくてはならない試薬である。いろいろな特異性をもつ分解酵素で、これらの高分子を壊し、取扱いに手ごろな大きさにするのが研究の第一段階である。酵素が使えなかったら、生命科学の進歩は、いまよりもはるかに遅れていたであろう。
(4)遺伝子操作のための手段として。今日、急速に進歩している遺伝子操作でも、酵素は欠かすことのできない武器である。目的のDNAを取り出したり、切ったり、つないだり、ほとんどの操作が酵素の助けを借りている。1970年から1980年にかけて、いろいろな酵素がみつかったからこそ、遺伝子操作が始まったといってもよい。
(5)その他。まださまざまな利用法がある。たとえば糖尿病の治療のためには、血液中のグルコース量を頻繁に測定しなければならないが、その一つの方法として、グルコース酸化酵素を利用するものがある。そのほか、酵素の特異性を利用したさまざまな臨床検査法がある。また近年、環境保全の立場から洗濯用の洗剤にリン酸を加えるのを避けるようになってきたが、それによる洗浄力の低下を補うために、微生物由来のタンパク質分解酵素を添加したものが広く使われるようになっている。
[笠井献一]
酵素異常
生体内の酵素を含むタンパク質の合成は遺伝子の情報によって行われるが、遺伝子の異常によって一つの酵素が欠損すると、そこで代謝がブロックされ、中間代謝産物が増加して先天性代謝異常をおこす。代表的な疾患にフェニルケトン尿症やアルカプトン尿症などがある。また、酵素異常によって正常と異なる分子構造をもつようになる分子病の解明など、分子生物学上でも注目されている。
[笠井献一]
食品
食品加工には酵素の作用を利用したものが多いが、その大部分は微生物の酵素によっている。最近、酵素そのものを食品に応用することも行われている。微生物の酵素を利用した食品には、醸造酒、食酢、みそ、しょうゆ、納豆、パン、チーズ、ヨーグルト、かつお節、漬物などがある。醸造酒に利用される主要な酵素系はアミラーゼとチマーゼである。前者は麹(こうじ)または麦芽(ばくが)、後者は酵母により供給されており、清酒は米麹と酵母、ビールは麦芽と酵母の組合せによってつくられる。食酢は酢酸菌を、みそは米麹を、しょうゆは麹菌を、納豆は納豆菌を、パンはパン用酵母を用い、菌のもつ酵素を利用している。チーズは子牛の第4胃より分泌されるキモシンという酵素および乳酸菌を利用し、ヨーグルトは乳酸菌を利用してつくられる。最近は微生物から酵素を抽出、精製した酵素剤がつくられ、これを食品加工に応用することが行われている。
[宮崎基嘉]
『今堀和友他著『現代化学シリーズ51 酵素分子』(1973・東京化学同人)』▽『船津勝編『酵素』(1976・講談社)』▽『徳重正信著『酵素のはたらき』(1988・東京大学出版会)』▽『H・デュガス著、井本泰治・山田秀徳・植田正訳『生物有機化学――酵素作用への化学的アプローチ』(1993・シュプリンガー・フェアラーク東京)』▽『一島英治著『酵素の化学』(1995・朝倉書店)』▽『西沢一俊・志村憲助編『新・入門酵素化学』改訂第2版(1995・南江堂)』▽『藤本大三郎著『酵素反応のしくみ――現代化学の最大の謎をさぐる』(1996・講談社)』▽『大野惇吉著『酵素反応の有機化学』(1997・丸善)』▽『一島英治著『酵素――ライフサイエンスとバイオテクノロジーの基礎』(2001・東海大学出版会)』▽『相沢益男著『最新酵素利用技術と応用展開』(2001・シーエムシー出版)』▽『宍戸和夫著『分子遺伝子のための核酸酵素テキストブック』(2004・コロナ社)』
改訂新版 世界大百科事典 「酵素」の意味・わかりやすい解説
酵素 (こうそ)
enzyme
生物の細胞内でつくられるタンパク質性の触媒の総称。生命の存在するところ,単細胞生物である微生物から,多細胞生物である植物,動物,そして人間にいたるまで,酵素はあらゆる生体の中で生命の営みに不可欠の存在である。酵素の主成分であるタンパク質は,各生物固有のDNAの遺伝情報に基づいて,約20種類のL型α-アミノ酸がNH2末端から順次ペプチド結合によって連結されることによって合成されたポリペプチド鎖が,構成アミノ酸残基の側鎖間相互作用によって三次元の立体構造を形成することになるが,酵素タンパク質は他の構造タンパク質,たとえば筋肉タンパク質や膜タンパク質と異なり,分子の一隅に活性中心を備えている。酵素の中にはまた,タンパク質以外に,金属イオン,特定の有機化合物としての補酵素,無機陽イオン・陰イオンなどの非タンパク質性分子やイオンを,その活性発現や構造保持に必須とするものも少なくない。
人類と酵素の出会い
酵素が上記のような物質であることは,今日誰でもよく知っている。酵素はその名が示すように,もともと発酵という自然現象と密接なかかわりをもっており,酵素の存在も,また実体も知られていなかった大昔に,すでに人類に日常利用されていたのである。酒,チーズ,みそ,しょうゆなどの各種発酵食品を製造するにあたり,材料としての米,麦,牛乳,大豆,あるいはブドウやリンゴなどの果実の品質の選定はもちろんのことながら,発酵に関与する微生物の菌株の選定,また発酵時の温度,水素イオン濃度(pH),酸素分圧などの諸条件の設定を,永年の経験から適切に行い,風味豊かな良質の食品や飲料を巧みに生産していたのは,まさに驚嘆に値する。発酵が適度に進行した時点で,加熱殺菌処理によって過度の反応を抑止し,アルコールが酸に変化するのを防止する技術も備えていたし,熊本地方の名産赤酒のように,通常の発酵の途中で灰汁を加えてpHをアルカリ性に変えることにより,代謝の流れをグリセロール蓄積の方向へと切り替えて甘みをふやすというように,近代発酵工学に勝るとも劣らぬ知恵と技術を持ち合わせていたのである。
酵素はこのようにして,日常生活に不可欠な存在として人類と深いかかわりをもってきたのであるが,その存在と実体が認識されたのは,近々,わずか数百年前のことであった。
酵素研究の歩み
上述のように,発酵という微生物の細胞の働きを通して,その実体がなんであるかは不明のまま,人類は酵素を有効に利用してきたのであるが,酵素を生命体から抽出単離して利用することが可能であることを実証したのは,パヤンAnselme Payen(1795-1871)とペルソJean François Persoz(1805-68)による酵素ジアスターゼの発見・命名(1832)と,麦芽の無細胞抽出液によるデンプンの糖化の達成(1833),さらにT.シュワンによる胃液中の消化酵素の発見(1836)とペプシンの命名がこれに続くいくつかの先駆的業績のきっかけとなった。
酵素はこうして生命現象そのものと決して不可分ではないという認識がしだいに深まってきたが,有名なJ.F.リービヒとL.パスツールの生気論争,またE.ブフナーによる酵母の無細胞抽出液によるアルコール発酵の達成(1896)を頂点として,酵素分子が生体内の代謝を行うタンパク質性の触媒であることへの理解が深まっていったが,決定的な証拠はまだ得られなかった。その間,キューネWilhelm Kühne(1837-1900)は,〈酵母の中に存在するもの〉の意味するギリシア語をもとにEnzymという名を付与した(1878)。
酵素がタンパク質であることを決定的に示したのはサムナーJames Batcheller Sumner(1887-1955)によるナタマメウレアーゼの結晶化の成功(1926)であった。当時生化学領域の研究活動はドイツを頂点とするヨーロッパ諸国が主流を占めていたのであるが,サムナーはアメリカの,しかも決して著名ではない研究者であったため,かなり激しい反論と疑いに直面せざるをえなかった。たとえば,結晶ウレアーゼがタンパク質であるのなら,プロテアーゼ(タンパク質分解酵素)で分解すれば触媒活性を失うはずであるのに,プロテアーゼで処理しても活性を失わなかった。サムナーが結晶化した物質はウレアーゼでもタンパク質でもないに違いないという主張がヨーロッパの研究者から発表されたりした。実のところ,ウレアーゼは確かにプロテアーゼに対する抵抗性が強いもので,よほど密な(かたい)構造を保持しているのであろう。このためもあって,結晶にもなりやすかったとも考えられる。
サムナーによるウレアーゼの結晶化にひき続き,種々の酵素の結晶化が次々に達成され,酵素がタンパク質を主成分とする分子であることを疑う人はなくなった。一方では超遠心分析法,電気泳動法,X線回折法など,タンパク質の物理的化学的諸性質の分析のための手法が急速に進歩したおかげで,酵素分子の構造,そしてまたその触媒機能,制御機能などがしだいに明らかになってきた。酵素研究の歩みの大要を表1にまとめた。
酵素の構造
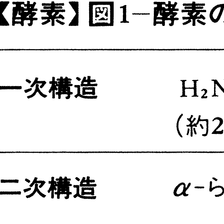
酵素タンパク質の分子量は約1万からはじまって大きいものは数百万におよぶが,1本のポリペプチド鎖としての大きさは,ほぼ4万~5万以下である。したがって,分子量がこれより大きい酵素は,少数の例外を除けば複数のポリペプチド,すなわちサブユニットの集合体と考えられる。生体内でつくられる酵素タンパク質の種類は数千から数万におよぶが,それぞれのタンパク質の構造と性質の違いの第1の原因は,ポリペプチド鎖を構成するアミノ酸残基の組成と配列順序の違いである。タンパク質の一次構造の違いが,DNAの遺伝情報の違いに基づくことは今日よく知られているが,酵素分子の個性は,この上にさらにサブユニットの組合せや,タンパク質分子以外の補欠因子族cofactorの種類によっても影響される。タンパク質だけから成る酵素に対して,活性発現に必要なタンパク質以外の成分を結合した分子をホロ酵素holoenzyme,ホロ酵素のタンパク質部分をアポ酵素apoenzymeと呼ぶ。補欠因子族の中には,ビタミンB1,B2,B6などの誘導体やATPのような有機物質も含まれており,これらをとくに補酵素coenzymeと呼ぶが,このほか,K⁺,Na⁺,Cl⁻,Ca2⁺などの陽イオン,陰イオン,金属イオンを要求する酵素も少なくない。
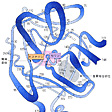
各種アミノ酸が酵素的に脱水縮合してペプチドが形成され,遺伝情報に従って一定の長さのポリペプチド鎖が合成されると,その中の各種アミノ酸残基の側鎖の相互作用により,α-らせん,β-シート,ランダムコイルなどの二次構造が形成される。さらにこれらの二次構造の組み合わさり方によって,球状,桿(かん)状,板状などの三次元構造(三次構造)が形成される。分子量が大きい酵素の場合には,先ほど触れたように,同種あるいは異種のポリペプチド鎖間の非共有結合性相互作用によって,サブユニットを有するいわゆるオリゴマー酵素が形成される。上述の二次~四次構造を,タンパク質の高次構造と呼ぶことがある(図1)。高次構造を備える点では,酵素以外の各種タンパク質,たとえば筋肉タンパク質,免疫タンパク質,膜タンパク質なども同様であるが,酵素の構造の最大の特徴は,分子の一部に活性中心を有することである。活性中心は活性部位,触媒中心などとも呼ばれ,基質や補酵素が結合するために必要な空間を指すが,多くの場合,酵素分子の表面から内部に向けて開けた細い間隙(かんげき)のような広がりとなっている(図2)。
→タンパク質
酵素の反応
酵素は他の化学触媒と異なり,ごく限られた範囲の基質substrateにしか作用しない。たとえば,塩酸で糖を加水分解する場合には,デンプンに限らず,種々の多糖やオリゴ糖が基質となるが,デンプンを基質とするアミラーゼはグリコーゲンにもキシラン(キシロースを主成分とする多糖の総称)にも作用しない。またL-アラニンを基質とするアラニン脱水素酵素はD-アラニンには作用しない。このような特徴を酵素の基質特異性と呼ぶ。一方ではまた,たとえ基質が同じであっても,酵素が違えば反応が変わってくる。たとえばL-グルタミン酸を基質としながら,ある酵素はその脱水素反応でα-ケトグルタル酸を生成し,ある酵素はアミノ基転移反応を触媒する。これを酵素の反応特異性と呼ぶ。酵素はこのように,基質と反応に関して,きわめて厳しい特異性を有している。
酵素が他の化学触媒と異なる大きな特徴がもう一つある。デンプンを塩酸で加水分解しようとすると,高温に加熱し,pHも強酸性にしないと反応がうまく進まない。これに対してアミラーゼを作用させる場合には,ほぼ中性付近のpHで,温度も25~30℃で速やかに進行する。また,圧力を加えないと進行しない化学反応も少なくない。酵素反応は,常温,常圧,生理的pHといった穏やかな条件の下でも効率よく進行するという特徴をもち,反応の活性化エネルギーもきわめて小さくて済む。
このような特徴はどうして生じるのか。酵素の作用をもう少し詳しく検討してみよう。酵素の触媒反応は図3のように三つの過程を経て進行する。まず酵素分子(E)の活性中心に基質(S)が結合して酵素・基質複合体(ESコンプレクス)が形成される。この複合体はこのモデルを提唱したL.ミハエリスにちなんでミハエリス・コンプレクスとも呼ばれるが,きわめて不安定で,触媒反応が進行しない場合には容易に両者は解離する。反応が進行する場合には活性中心において基質は生成物に変化し,その後その生成物(P)は酵素から遊離する。こうして元の状態に戻った酵素は,すぐに次の基質に作用することになる。この一連の反応が1回転する速度を回転率turnover rateまたは分子活性moleculer activityで表し,通常1molの酵素分子が1分間に変化させる基質のモル数を単位として用いる。その値は生理的条件下で数千~数万である。いま述べた反応を式で表すと次のようになる。
E+S⇄ES─→E+P
ESコンプレクスの存在は,はじめミハエリスが作業仮説として提唱したが,近年になって,分光学的方法やX線回折法などによって,その実体を実験的にとらえた例も蓄積されてきている。いま通常の化学触媒あるいは酵素の濃度,pH,温度などの条件を一定に保ち,基質の濃度だけを変化させながら,反応の初速度を測定すると,化学触媒の場合には図4-aのような直線が得られるのに対して,酵素の場合には通常図4-bのような曲線が得られる。これは双曲線の一部に相当する。基質の濃度が無限大になると,反応初速度は一定値に達し,それ以上は増加しない。そのときの反応速度を最大反応速度maximal velocityと呼び,Vmaxで表す。またVmaxの半分の値を与える基質の濃度をミハエリス定数と呼び,Kmで表す。VmaxとKmは酵素反応の速度論の解析に最も重要なパラメーターである。たとえば,L-アラニンを基質とする酵素にD-アラニンを与えると,D-アラニンはその酵素の活性中心に結合することはできるが触媒反応は進行しない。そしてL-アラニンとD-アラニンの濃度比が1より小さければ,酵素の活性は可逆的に低下し,図5-(b)のような関係となる。これを拮抗阻害,または競争阻害と呼ぶ。つまり活性中心の奪い合いが起こることを示している。阻害剤の中には,図5-(c)のように非拮抗型のものも珍しくない。ところで,酵素の中には基質飽和曲線が双曲線性でなく,図6のようにS字性(シグモイド性)や矩形に近い形を与えるものも少なくない。この現象はアロステリック酵素によく見られるもので,協同効果cooperative effectsと呼ばれるが,このような曲線の性質をヒル係数Hill coefficient(nと略記)というパラメーターで表す。ヒル係数は図8の作図によって求められる。
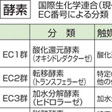
次に酵素の反応を種類別に考察してみよう。国際酵素委員会という組織のもとに,これまでに報告されているすべての酵素は六つの種類に大別されている(表2)。1は酸化還元,2は転移(移転),3は加水分解,4は脱離(解裂),5は異性化,6は結合(合成)の各反応を触媒する酵素を含んでいる。たとえばアルコール脱水素酵素はEC1,1,1,1の番号を与えられているが,この最初の1は酸化還元酵素であること,次の1はNADを補酵素として要求すること,次の1はCH-OH結合に作用すること,そして最後の1はそのグループの個別番号を指している。1980年ころまでにすでに登録番号が与えられている酵素の数は2000を超えているが,1万に達するのも遠くはないと思われる。
酵素の存在様式
すべての酵素がタンパク質を主成分とする点では変わりないが,生体内における存在状態や機能発現の条件は決して単純ではない。まず組成のうえからいえば,1本のポリペプチド鎖のみから成るモノマー酵素(単量体酵素)と,複数の同種あるいは異種サブユニットの会合体として存在するオリゴマー酵素に分けられる。一方ではタンパク質のみから成る酵素に対して,糖,脂質,その他の非タンパク質性分子が共有結合している複合タンパク質性のものもある。活性の発現のために,補酵素や陽イオン,陰イオンを要求し,それらが強固に活性中心に結合したものもあれば,タンパク質さえあれば十分という酵素もある。生体内ではまた,代謝の流れとしてつながっている一連の化学反応を,反応の順番に空間配置したいくつかの酵素が触媒してゆくという,いわゆる多酵素複合体が知られており,長鎖脂肪酸の生合成(図9)やα-ケト酸の脱水素反応を触媒している。一方では,タンパク質合成が終了した時点では,不活性分子として存在しながら,必要に応じてその一部がプロテアーゼ限定分解を受け,その結果酵素活性が発現するという例も少なからず知られている。キモトリプシノゲンからキモトリプシン,ペプシノゲンからペプシンの生成のように,プロテアーゼに多くその例が見られる。生命活動を支えるうえで,酵素が制御機能を備えるという例も珍しくない。代謝のフィードバック制御がその代表的な例であるが,これについては後で述べる。同じ反応を触媒するにもかかわらず,同一細胞内に2種以上の分子として存在する,いわゆるイソ酵素(アイソザイム)の例も少なからず知られている。乳酸脱水素酵素のように,2種(H型とM型)のサブユニットの組合せで四量体酵素をつくると,合計5種類のアイソザイムがつくられる(図7)が,それらの分布は器官ごとに遺伝的に決められており,各器官においてそれぞれ独特の代謝調節に寄与しているといわれている。
酵素と生命
生命活動を支える各種の化学反応(物質の合成・分解,輸送,排出,解毒,エネルギーの供給など)は,すべて酵素の関与のもとに営まれている。しかしながら,生体という場は試験管やビーカーの中と異なり,各種の器官,組織,その他の複雑な構造体から成るために,きわめて不均一な場といえる。たとえば酵素も基質も十分量存在していても,両者の間に不透性の膜や壁があれば,反応は起こりえない。酵素の局在性,局在化が生体の中では大きな意味をもっているのである。
酵素が生命を支えるという重要な役割をになっていることを明確に示すきっかけとなる発見がなされたのは,まだわずか20年あまり前にほかならない。アンバーガーH.E.UmbargerやパーディーA.B.Pardeeの観察によると,イソロイシンやトリプトファンなどの生体物質が細胞内で必要以上に生産されると,それらの生合成を自動的に抑制するしくみが作動することがわかったが,さらによく調べた結果,物質生合成系の初発段階に位置する特定の酵素の活性が,その系の最終生成物によるフィードバック阻害を受けるというしくみが明らかになった。フィードバック阻害は,先に知られていた酵素合成の抑制,すなわちリプレッションとは本質的に異なり,特定の酵素分子と特定の最初生成物との特異的相互作用に由来している。パーディーらの研究の結果,たとえば図10,11に示すアスパラギン酸カルバモイル転移酵素(ATCアーゼ)の場合には,最終産物であるCTP(シチジン三リン酸)が,初発段階の反応を触媒するATCアーゼの調節サブユニットに存在している制御中心に結合し,酵素タンパク質の高次構造変化を介して酵素の活性が調節されるというしくみが判明した。ちょうどオペロン説を発表したJ.モノーがこのような現象に興味を示し,基質とは構造が異なる物質による活性の調節という意味で,アロステリック効果allosteric effectsという名を与えた。アロステリック効果は,代謝のフィードバック阻害にとどまらず,ヘモグロビンに対する酸素分子の結合,膜タンパク質や筋肉タンパク質の機能制御などに関しても重要な役割をになっていることがしだいに明らかになってきた。このように,酵素の中には,単なる触媒としてでなく,生命活動の調節に大きな役割を果たしているものも少なくないことが最近強く認識されてきた。アロステリック効果に加えて,もう一つの重要な調節が,酵素による酵素タンパク質の修飾によって行われている。
筋肉のグリコーゲンホスホリラーゼは分子量約10万のサブユニット2個からなるb型と,そのほぼ2倍の分子量としてサブユニット4個からなるa型の2種類が知られている。しかしながら,b型の会合体がそのままa型に相当するのではなく,各サブユニットの特定のセリン残基にオルトリン酸がエステル結合でくっついた形をとっている。b型からa型への転換は特定の酵素ホスホリラーゼキナーゼによって触媒され,セリン残基に結合するリン酸は,ATPから供給される。a型からb型への転換も酵素ホスファターゼによって触媒される。a型とb型は,その活性の発現に要求されるAMP(アデノシン一リン酸)の度合が異なっている。a型はAMPがなくても60%の活性をもつが,b型はAMPなしではほとんど活性がない。このような性質は,ホスホリラーゼによる解糖系代謝の調節に,実は重要な意味をもっているのである。酵素による酵素の修飾のもう一つの代表的な例は,大腸菌のグルタミン合成酵素のアデニリル化である。大腸菌において,グルタミン合成反応は各種生体物質の生合成の初発段階に位置し,それらの物質によるフィードバック阻害を受けるが,酵素分子の特定のチロシン残基にAMPが共有結合すると,フィードバック感受性と金属要求性が大きく変化することが,スタットマンE.R.Stadtmanらによって明らかにされた。
酵素異常
アフリカの原住民やアメリカの黒人の中に多発する先天性の貧血症がある。それらの黒人の血液を採取し,赤血球を顕微鏡で調べてみると,時間とともに鎌状に変形し,やがて赤血球が溶血する。この貧血症患者の赤血球からヘモグロビンをとり出し,正常なヘモグロビンとの比較を行った結果,L.ポーリングらはそのサブユニットの中のβ鎖のグルタミン酸がバリンに突然変異している事実をつきとめた。ポーリングはこれを分子病と呼ぶことにしたが,タンパク質の生合成や一次構造に変異が起こった結果,触媒機能に異常が起こる例もその後いくつか見いだされてきた。もっともよく知られているのがフェニルケトン尿症である。この病気はフェニルアラニンをチロシンに変えるフェニルアラニン水酸化酵素の欠損に由来する病気であり,新生児の時点で処置しておかないと,将来脳神経系に大きな障害を残すことになる。乳幼児に異常が発見されたら,食餌の中からフェニルアラニンを除去しておけば障害は防止できるのである。酵素異常疾患の原因は必ずしも先天的なものに限らず,後天的に酵素の生合成,分解の速度が異常をきたす場合,酵素分子の物性や構造が変化する場合など,原因としては種々考えられる。
→先天性代謝異常
酵素の利用と応用
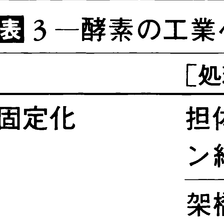
これまでに述べた酵素の種々の特徴を活用して,食品・医薬・農薬・工業用物質などを効率よく,しかも高純度で生産する試みが広範囲で行われ,すでに実用化されたものも少なくない。また一方,プロテアーゼの投与による蓄膿症の治療をはじめ,酵素を直接医療に用いる例も少なくなく,多くの成果が得られている。とくに最近の固定化法は広く利用されている。これらを表3,4にまとめた。
→酵素工業
執筆者:徳重 正信
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「酵素」の解説
酵素
コウソ
enzyme
エンザイムともいう.生体内の種々の化学反応を触媒する機能をもつタンパク質.酵素は無機あるいは錯塩触媒と異なり,
(1)常温,中性という緩和な条件で化学反応を触媒する,
(2)基質特異性がきわめて高い,
(3)触媒効率が大である,
という特徴を有する.現在までに約1000種類の酵素が発見され,1926年,J.B. Sumner(サムナー)によってウレアーゼが結晶化されて以来,約150種類が結晶化されている.酵素によって触媒される化学反応を分類すると,
(1)酸化還元反応,
(2)転移反応,
(3)加水分解反応,
(4)脱離反応(リアーゼ),
(5)異性化反応,
(6)合成反応,
である.酵素はいずれもタンパク質であるが,タンパク質のみで機能を発現するものと,タンパク質と低分子化合物が結合して機能を発現するものとがある.その低分子化合物を補酵素あるいは補欠分子族といい,ニコチンアミドアデニンジヌクレオチド(NAD)およびそのリン酸塩(NADP),ビタミン B2,B6,B12,フラビンモノヌクレオチド(FMN),フラビンアデニンジヌクレオチド(FAD),ヘム,銅,亜鉛などがある.各種酵素タンパク質のアミノ酸組成,分子量などの物理化学的性質,タンパク質としての一次,二次,三次,四次構造が解明され,さらにX線回折による研究より立体構造のモデルが提唱されている.酵素の命名は既知酵素の数が増大した現在,混乱を避けるため,国際生化学連合の提案した系統名が用いられつつあるが,日常の便宜のため常用名も使用されている.たとえば,常用名でアルコールデヒドロゲナーゼはアルコールを脱水素してアルデヒドにし,同時にNADを還元する反応を触媒する酵素であり,系統名ではアルコール:NADオキシドレダクターゼといい,EC番号(酵素番号)はEC 1.1.1.1である.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「酵素」の意味・わかりやすい解説
酵素【こうそ】
→関連項目アイソザイム|アデノシンデアミナーゼ|アロステリック酵素|ウィルシュテッター|γ-GTP|サムナー|GOT|GPT|触媒|生合成
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「酵素」の解説
酵素
ブリタニカ国際大百科事典 小項目事典 「酵素」の意味・わかりやすい解説
酵素
こうそ
enzyme
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
生活習慣病用語辞典 「酵素」の解説
酵素
出典 あなたの健康をサポート QUPiO(クピオ)生活習慣病用語辞典について 情報
世界大百科事典(旧版)内の酵素の言及
【酵素工業】より
…酵素は古来醸造食品の製造において,一部の工程を遂行するために利用されてきた。現在でもビールの醸造でデンプンの糖化に麦芽のアミラーゼが,またチーズの製造に際し乳タンパク質の凝固に子牛の胃液から作られたレンニンが使用されているが,これらがいつごろから始まったかは定かでなく,あるものは有史以前にさかのぼることができると考えられる。…
【タンパク質(蛋白質)】より
…タンパク質は,生物体を構成するもっとも基本的な物質であり,さまざまな重要な働きをしている。細胞内外に見られる種々の構造は,主としてタンパク質により形成されるし,生物に必須の化学反応を触媒する酵素は,タンパク質でできている。そして,生体運動,神経系の活動,物質の輸送,免疫反応などもタンパク質が行っている。…
【補酵素】より
…助酵素,コエンザイムとも呼ばれる。酵素の活性発現のためには,タンパク質以外の分子が,可逆的にタンパク質成分に結合することが必要条件とされるものが少なくない。…
【誘導酵素】より
…特定の物質の存在によって合成速度が増加する酵素群。生命の営む多彩な活動は多種多様な酵素によって支えられている。…
※「酵素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
目次 飼養文化 北アメリカ 北方ユーラシア偶蹄目シカ科の哺乳類。北アメリカでは野生種はカリブーcaribouと呼ばれる。角が雄だけでなく雌にもふつうある。体長130~220cm,尾長7~20cm,...