翻訳|carbon
精選版 日本国語大辞典 「炭素」の意味・読み・例文・類語
たん‐そ【炭素】
- 〘 名詞 〙 炭素族元素の一つ。元素記号C 原子番号六。原子量一二・〇一〇七。無定形炭素・黒鉛・ダイヤモンドの三つの同素体がある。天然には炭酸塩として水成岩中に、二酸化炭素として気圏・水圏に、有機化合物として生物界に広く存在する。きわめて融解しにくく、高温では昇華する。化学的には無定形炭素が最も活性で、黒鉛・ダイヤモンドの順となる。有機・無機いずれの溶媒にも全く溶けず、高温で鉄・コバルト・ニッケル・白金属元素などにわずかに溶けて炭化物をつくる。ダイヤモンドはほとんど反応しない。放射性同位体の炭素一四は、放射性トレーサーや、考古学の年代測定に利用される。カーボン。
- [初出の実例]「炭素は炭中黒色の物質なり」(出典:遠西医方名物考補遺(1834)八)
日本大百科全書(ニッポニカ) 「炭素」の意味・わかりやすい解説
炭素
たんそ
carbon
周期表第14族に属し、炭素族元素の一つ。カーボンともいう。
歴史
木炭は古代から世界各民族普遍のものであり、燃料とするだけでなく、防腐剤、あるいは金属製錬に用いられていた。またダイヤモンドについては『旧約聖書』や、インドの古代聖典にも記載がある。ダイヤモンドの名は、これ以上の硬さのものがないことから、征服されないという意味のギリシア語admasに由来し、黒鉛(鉱物名は石墨(せきぼく)、グラファイト)は古く筆記に使われたことから、書くという意味のギリシア語grafeinに由来する。炭素carbonの語源ははっきりしないが、ラテン語の木炭carboに由来するらしい。
ダイヤモンドが炭素からなることが知られるようになったのは、1771年フランスのマケールのダイヤモンドの燃焼に始まり、1772年フランスのラボアジエの実験によって証明された。すなわち密閉ガラス鐘中のダイヤモンドにレンズで集光して照射、加熱燃焼させると二酸化炭素のみを生ずることを発見したことによる。さらにフランスのギトン・ドゥ・モルボが、ダイヤモンドが石墨を経て二酸化炭素となることを示し、ダイヤモンドと石墨が炭素の同素体であることがわかった。
炭素からのダイヤモンドの製造は、19世紀から多くの試みがなされたが成功しなかった。しかし1955年アメリカのゼネラルエレクトリック社の研究者たちは、高温、超高圧下で、鉄‐ニッケル合金を溶媒にして人工ダイヤモンドの製造に成功した。日本でも1961年(昭和36)以降量産されている。
[守永健一・中原勝儼]
存在
宇宙には4番目に多い元素で、恒星のエネルギーサイクルに含まれる。ダイヤモンドは隕石(いんせき)中にもみつかっている。主として石灰石や方解石CaCO3、マグネサイトMgCO3、ドロマイトCaCO3・MgCO3のような炭酸塩として水成岩中に存在する。また、二酸化炭素として大気中に約0.03%含まれ、海水中の全炭酸(分子状のCO2のほかH2CO3、HCO3-、CO32-)はこれと平衡を保っている。燃料源として、また工業的に重要な化学薬品の原料となる石炭や石油の成分として、さらに有機化合物として生物圏の重要な構成成分である。生命の維持と機械その他の動力源として必要なエネルギーの大部分は、炭素とその化合物の酸化反応に仰いでいる。植物は空気中の二酸化炭素と水から光合成により炭水化物(含水炭素または糖類ともいう)を合成する。動物はこの炭水化物を摂取して呼吸作用により、また死後はバクテリアによる肉体組織の分解により二酸化炭素を大気に戻す。このような動物と植物を結び付ける鎖の輪が地表における炭素のサイクルである。
[守永健一・中原勝儼]
炭素の同位体
天然に存在する同位体組成は、炭素12が98.90%、炭素13が1.10%、ほかに放射性同位体の炭素10、炭素11、炭素14、炭素15の4種類がある。炭素12は原子量の基準として選ばれ、炭素12原子1個の質量の12分の1が1原子質量単位である。炭素13のみが核スピンをもつので、核磁気共鳴吸収法による有機化合物の構造決定に利用される。
炭素14(β(ベータ)-放射、半減期5730年)はトレーサーとして広く使われ、核反応14N(n,p)14Cによってつくられる。天然による上層大気中では宇宙線によってつくられる中性子と窒素から炭素14が補給されるので、空気中の二酸化炭素に含まれる炭素14の量はほぼ一定である。これが生物体の有機物として固定されると、補給が止まり約5000年の半減期で減少する。もし有機物がつくられたときの炭素14の量がわかれば、現在それがどれだけ減少しているかを測って、その生物が生きていたときから現在までの経過時間を知ることができる。このように炭素14は年代測定に利用される。
[守永健一・中原勝儼]
炭素の同素体、その構造の相違
炭素の同素体としてはダイヤモンド、黒鉛および無定形炭素の三つがあるとされてきたが、最近、フラーレン(1985)、カーボンナノチューブ(1991)、カルビン(1992)などが発見されている。カルビンはアセチレンを触媒の存在下酸化して得られる黒色物質で、六方晶系の半導体。-C≡C-が繰り返されるポリイン型と=C=C=C=二重結合の積み重なったクムレン型とがあるが、いずれも鎖状構造の直鎖分子である。
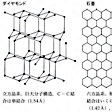
炭素の最外殻の電子配置は2s22p2で、炭素原子がこの合計4個の原子価電子によって共有結合をつくる方法には3通りがある。そのうちの2通りsp3混成とsp2混成とよばれる結合の仕方が、それぞれダイヤモンドと黒鉛の構造にみられる()。sp3混成では、正四面体の中心から頂点の方向に向かう4個の軌道を使って炭素原子は4個の等価な結合をつくる。ダイヤモンドは、正四面体の中心に位置する炭素原子が正四面体の各頂点に位置する4個の他の炭素原子と結合するという立体配置が三次元方向に伸びた巨大分子である。一方、sp2混成では、正三角形の中心から頂点の方向に向かう3個の軌道を使って炭素原子は3個の等価な結合をつくり、残る1個のp軌道は三角形の平面に垂直な方向を向いている。黒鉛では、炭素原子が三角形の中心にあって、正三角形の各頂点にある炭素原子と結合して正六角形の炭素6員環が融合したような網状平面ができあがり、それが規則的に積み重なった層状構造をとっている。同じ平面内で各炭素原子は3個の電子で他の3個の炭素原子と互いに共有結合し、残りの1個の電子は金属内の電子と同じように動きやすい状態になっている(平面に垂直なp軌道に入っている、ある炭素原子の電子が、周りのすべての原子の同じ種類のp電子と結合をつくったり、切ったりしている。すなわちp電子は炭素6員環からなる網状平面内の炭素原子上を動き回る)。炭素平面間を結び付けているのは弱いファン・デル・ワールス力である。炭素原子の4個の価電子がすべて共有結合に使われている巨大分子のダイヤモンドが硬くて電気を導かないのに、黒鉛が電気を導き、軟らかく劈開(へきかい)しやすい性質を示すのは、両者のこのような構造の差異に原因がある。黒鉛の誘導体としてCFとかC2Kなどの層間化合物が知られているのもこのためである。
いわゆる無定形炭素とよばれるものには木炭、獣炭、煤、カーボンブラック、コークスなどが含まれる。無定形というのは、黒鉛の微細結晶の網目が無秩序に乱れ、層もひずんだりして集合したもので、つくり方によって炭素平面の大きさやその積み重なり方も変わってくる。黒鉛はダイヤモンドよりいくぶん化学反応性が大きいが、無定形炭素は黒鉛よりもいっそう反応性が増している。高温では多くの元素と直接に化合する。たとえば、水素、硫黄(いおう)と化合してそれぞれアセチレンなどの炭化水素、二硫化炭素をつくり、ケイ素、カルシウム、アルミニウム、鉄などと炭化物をつくる。また、還元剤として多くの酸化物から酸素を奪って、一酸化炭素や二酸化炭素を生じる。アルカリなどの化学薬品に対してきわめて安定である。炭素の性質についてはも参照。
フラーレンやカーボンナノチューブ、カルビンなどは、いわゆるニューカーボンファミリーとよばれ、各種の分野での応用が期待されている。
[守永健一・中原勝儼]
製法
工業的に多くの用途をもつ炭素材料は次のようにして得られる。原料有機物を熱分解したのち、高温で炭素以外の元素を放出させ(炭素化)、さらにこれを3000℃付近での熱処理によって黒鉛の構造に近づける(黒鉛化)方法がとられる。カーボンブラックは、炭化水素ガス、または油などを霧状にして1300℃以上で熱分解してつくる。人造黒鉛は、コークスを結合材と成形、焼成したのち、3000℃に熱して黒鉛化させる。ハロゲンガスを通しながら高温で処理すると高純度のものが得られる。このほか、ポリアクリロニトリルなどの繊維を加熱処理してそのまま固相炭素化させた炭素繊維(軽くて強い)やガラス状炭素(等方性の導電体)、熱分解炭素など特殊な機能性の高い炭素材料が開発されている。
[守永健一・中原勝儼]
用途
ダイヤモンドは宝石として用いられるほか、その硬さを利用して研磨材や切削材料として用いられる。黒鉛は原子炉の中性子減速剤、各種の電極、るつぼ、鉛筆の芯、減摩材などに用いられる。無定形炭素はその形状や性質によって燃料その他いろいろな用途がある。粉末の活性炭は吸着材として重要であり、微粒子のカーボンブラックは顔料、印刷インキ、ゴムの充填(じゅうてん)剤などに用いられる。炭素繊維は高強度、高張性炭素繊維として各種スポーツ用品に用いられる。
[守永健一・中原勝儼]
『日本化学会編『炭素第三の同素体フラーレンの化学』(1999・学会出版センター)』▽『嶋崎勝乗他著『炭素応用技術』普及版(2001・シーエムシー)』▽『炭素材料学会編『最新の炭素材料実験技術 分析・解析編』『最新の炭素材料実験技術 物性・材料評価編』(2001、2003・サイペック)』
炭素(データノート)
たんそでーたのーと
炭素
元素記号 C
原子番号 6
原子量 12.011
融点 3600℃
沸点 4800℃
比重 ダイヤモンド 3.15~3.53
石墨 1.9~2.3
無定形炭素 1.8~2.1
結晶系 ダイヤモンド 立方
石墨 六方
元素存在度 宇宙 1.35×107(第4位)
(Si106個当りの原子数)
地殻 200ppm(第16位)
海水 28×103μg/dm3
改訂新版 世界大百科事典 「炭素」の意味・わかりやすい解説
炭素 (たんそ)
carbon
周期表第Ⅳ B族に属する炭素族元素の一つ。非金属元素としては硫黄とともに最も古く紀元前から知られている元素の一つである。無定形炭素のすす(煤)や炭は古代から知られており,ダイヤモンドは旧約聖書中にその記載がある。ただしダイヤモンドが炭素からなることがわかったのは,1772年A.L.ラボアジエがダイヤモンドの燃焼によって二酸化炭素のみを生ずることを見いだし,96年イギリスのテナントSmithson Tennant(1761-1815)がダイヤモンドが炭素のみからなることを明らかにして以来である。日本語の炭素という元素名は,ドイツ語のKohlenstoff(〈炭の素〉の意)と同じである。英語のcarbonの語源ははっきりしないが,ラテン語のcarbo(〈石炭,木炭〉の意)に由来するといわれる。graphite(黒鉛,石墨)は筆記具に使われたことからギリシア語のgrafein(〈書く〉の意)に由来するものであり,diamond(ダイヤモンド)は最も硬いことから〈征服されないもの〉という意味のギリシア語adamasに由来するといわれる。
天然には12C(98.90%)と13C(1.10%)の2種の同位体があり,12Cは原子量の標準(12Cの原子量を12.0000000とする)となっている。放射性同位体としては10C( β⁺,γほか,半減期19.2秒),11C( β⁺,EC(電子捕獲),20.38分),14C( β⁻,5730年),15C( β⁻,γほか,2.449秒)がある。単体としてはすすなどの無定形炭素,黒鉛,ダイヤモンドなどの同素体が存在し,その他各種の化合物として自然界に広く分布する。すなわち気圏には二酸化炭素,メタンその他として,水圏には炭酸イオン,岩石圏には炭酸塩などとして存在し,さらに石炭,石油の成分であり,しかも各種の有機化合物として広く生物圏に分布している。またこれらの自然界に存在する炭素は各種の経路をとって循環している。すなわち植物は大気中の二酸化炭素と水とから光合成によって炭水化物その他をつくり,動物はこの炭水化物その他をとりこんで消化,吸収して分解するし,さらに死んでからはバクテリアなどの作用ですべて分解されて二酸化炭素などとなって大気中にもどる。あるいは,生物体が石炭,石油などの化石燃料や石灰岩などになり,燃焼その他によって大気中に移行する。これを,炭素の循環といっている。
性質
炭素の同素体としては無定形炭素,黒鉛,ダイヤモンドがあるが,そのほか直鎖状炭素分子からなるものもあるとされている。それぞれの物理学的および化学的性質はかなり違っているが,それらの違いはそれぞれの構造の違いに由来するものであることが多い。ダイヤモンドは,一つの炭素原子を中心として正四面体をつくるように四つの炭素原子が単結合によって結合し,さらにそれらの炭素原子が四面体形に四つの炭素原子と結合して三次元的に成長した巨大分子構造をもち,単結晶一つが,いわば一つの分子といえるものである。このため電導性がなく,完全な絶縁体であり,これまで知られている物質中での最高の硬度をもつことにもなるし,強い共有結合でつながっていることから化学的にはきわめて不活性でほとんどの試薬と反応しない。これに対し黒鉛は,炭素原子の6員環が平面的に無限につながった平面型巨大分子(ポリセン)が,層をなして重なったものである。ポリセンの平面共役二重結合系での電子易動性から電導性を生じ,電極などに利用されるほどになる。またこの層状構造からいって,軟らかく,滑性があり,へき開しやすいが,巨大分子であるから反応性は少ない。しかしこれらの炭素平面間はファン・デル・ワールス力で結びつけられているだけであって,その間隔は炭素原子間の1.42Åに対して3.53Åとかなり広く,この層間に他原子が入りこんだいわゆる挿入化合物をつくる(たとえばCFとかC8Kなど)。これらの構造からいってダイヤモンドと黒鉛の比重が違うこともわかる。ダイヤモンドは黒鉛よりはるかに密度が高いので,黒鉛からダイヤモンドをつくるのにはきわめて高い圧力が必要であり,1955年,クロム,鉄,白金などの金属を触媒として,約3000Kで,125kbar以上の高圧を利用して初めて転換に成功した。現在工業用として十分な品質のものならば0.1カラット程度の大きさのものがつくられている。ダイヤモンドの結晶を芯として炭素質のガス中で結晶を成長させることにより,より低圧で人造ダイヤモンドをつくる試みもなされている。無定形炭素は,黒鉛の微細結晶が集まったものであるから,ダイヤモンドや黒鉛と比べるとはるかに活性が強い。
融点は各同素体ともかなり高く,高温ではしばしば昇華する。酸,アルカリ水溶液やすべての溶媒に溶けないが,高温では鉄,コバルト,ニッケルおよび白金族元素にやや溶ける。無定形炭素は塩素酸塩と硝酸の混合物により容易に酸化されるが,黒鉛は徐々に酸化される。ダイヤモンドはこのような強い酸化剤によってもほとんど侵されない。黒鉛は酸素中で600~700℃に加熱すると二酸化炭素となる。ダイヤモンドは空気を断って2000℃に強熱すると黒鉛になるが,空気中では700~900℃で燃焼する。炭素の電気陰性度は2.5で中程度の値をもち,金属ないし金属性元素と結合し,炭化物をつくるほか,二酸化炭素,二硫化炭素,四塩化炭素,各種炭酸塩などの無機化合物を生成するが,最も特徴のあることは膨大な数の各種有機化合物をつくることである。これは炭素が最も典型的な非金属元素であって,同じ元素の原子どうしが連なって結合する現象,すなわちカートネーションcatenationの現象を示すことによるものである。この傾向は全元素中で炭素が最も強く,一般には周期表中での位置が炭素から遠い元素ほど現れ方が減少する。この炭素-炭素の鎖をつくる能力が有機化学の広い分野を開くことになる。全元素中関連する化合物の数が最も多いのは水素であるが,炭素はそれに次ぐものである。
製法・用途
工業的に各種炭素製品がつくられており,原料としては石炭,石油,天然ガス,天然黒鉛などが普通に用いられるが,目的に応じて合成高分子なども用いられる。無定形炭素としては,カーボンブラックと活性炭が最も多くつくられる。カーボンブラックは自動車のタイヤなどをはじめとして各種ゴムの充てん剤として多く用いられ,また印刷インキとして用いられるが,主として天然ガスあるいは石油の不完全燃焼によってつくられる。活性炭は,飲料水などの浄水,食品工業その他での脱色などの吸着剤として広く用いられており,各種木材,ヤシ殻,石炭その他を空気を断って600~900℃に熱して炭化してから,塩化亜鉛などの金属塩化物を作用させて賦活してつくる。さらに最近広くつくられまた用いられているものはガラス状炭素と炭素繊維である。前者は有機物の固相熱分解によってつくられる硬質炭素で,外観や破面はガラス状である。黒鉛構造の発達が極端に抑えられていることから,等方性,不通気性かつ密度が小さく(1.4~1.6g/cm3),発熱体,るつぼ,保護管,板,ジグなどとして用途が開発されつつある。後者の炭素繊維はきわめて強い機械性,耐摩耗性をもち,航空機,船舶,機械,建築などの各種工事用に用いられている。また黒鉛は天然産のもののみならず人造品が大量につくられ,炭素電極および発熱体として広く用いられている。黒鉛電極の主原料は石油コークスであり,炭素電極には煆焼(かしよう)無煙炭,電解板には石炭ピッチコークスなどが用いられ,これらを粉砕し,成形,焼成してつくられる。そのほか黒鉛は,耐火物,電機用ブラシなどとしても用いられる。人造ダイヤモンドは主として工業用研削といしなどとして用いられる。
執筆者:中原 勝儼
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「炭素」の解説
炭素
タンソ
carbon
C.原子番号6の元素.電子配置[He]2s22p2の周期表14族非金属元素.原子量12.0107(8).天然同位体は安定な質量数12(98.93(8)%),13(1.07(8)%)のほか微量の14が存在する.質量数8~22の放射性同位体核種が知られている.炭素の単体,黒鉛,すすなどは古くから知られていたが,元素の一つであるとわかったのは18世紀中ごろで,1772年フランスのA.L. Lavoisier(ラボアジエ)によって炭,黒鉛,ダイヤモンドが同じ物質を含んでいることが示され,1783年フランス語の“炭”charbonと区別して“carbon”の名が与えられた.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で,加爾勃尼究母(カルボニキュム),炭素としている.炭素はオランダ語の元素名Koolstof(ドイツ語Kohlenstoff)を直訳したと思われる.
天然に炭酸塩,二酸化炭素,有機化合物として,岩石圏,気圏,水圏,生物圏に広く分布している.また炭素の一部は動物,植物体の呼吸作用,同化作用そのほかにより各圏の間を循環している.黒鉛,ダイヤモンドなどの単体,金属の炭酸塩,石油,石炭などとして産出する.炭素の同素体にはダイヤモンド(立方晶),黒鉛(六方晶),無定形炭素,フラーレン,ナノチューブなどがある.質量数12の同位体は原子量の標準である.密度:ダイヤモンド3.513 g cm-3(20 ℃),黒鉛2.26 g cm-3(20 ℃),無定形炭素1.8~2.1 g cm-3,フラーレン C601.65 g cm-3(20 ℃).融点:ダイヤモンド3550 ℃,4800 ℃ で昇華,黒鉛3530 ℃,フラーレン C60530 ℃ で昇華.第一イオン化エネルギー11.260 eV.CⅣイオン半径(四配位)0.029 nm,C-C結合距離は一重結合の一般値0.1541,二重結合0.1337,三重結合0.1205 nm,芳香族0.1395 nm.酸化数2,4.炭素はきわめて融解しにくく,高温では昇華する.通常の溶媒には不溶であるが,融解した鉄,コバルト,ニッケル,白金族元素には比較的よく溶け,冷却すると,黒鉛として析出する.ほかの物質との反応は一般に乏しいが,無定形炭素がもっとも反応性が大きく,黒鉛,ダイヤモンドの順に減少し,ダイヤモンドはほとんど反応しない.高温では,多くの元素と炭化物をつくる.炭素はカテナ化が特徴となっている数少ない元素の一つである.水素を除いて炭素は化合物の数がもっとも多い.不活性雰囲気中で炭素電極間にアーク放電を行うと,大量のすすとともに相当量の C60 がごく少量の C70,C76,C84 のような関連フラーレン類とともに生成する.炭素は有機化学における中心的な役割とは別に多数の無機化合物および広範な有機金属化合物の系列をつくる.14C は二次宇宙線中の中性子による14N(n,p)14C反応で,大気中の上層で連続的に生成され,二酸化炭素となって代謝により生体中に取り入れられている.生体中では 14C と 12C との平衡が成立していて,14C の含有量が15.3 dpm/gC と推定されている.14C は半減期5730 y のβ-崩壊核種である.これを利用して,考古学や古生物学の年代決定が行われる.近年,加速器を利用する年代測定法([別用語参照]加速器年代測定法)が開発され,年代測定可能範囲が広がった.ダイヤモンド,黒鉛以外の単体としてはコークス,カーボンブラック,活性炭,炭素繊維などが産業用に量産される.炭素繊維強化プラスチック(CFRP)は自動車,航空機材料,スポーツ用品に多用される.わが国で世界市場の約80% の炭素繊維を生産している.黒鉛は電極,塗料,減摩剤,るつぼ,中性子減速材などに,ダイヤモンドは宝石,切削剤,研磨剤などに,また無定形炭素は活性炭,ゴム充填剤,顔料などに用いられる.1991年に飯島澄男が見いだしたカーボンナノチューブは高張力鋼の2倍の引張強度をもち,構造に応じて電気の良導体から半導体までの性質を示すので,冷熱型高輝度光源ランプや電界放射型薄型のディスプレイの電子源,走査型電子顕微鏡や原子間力顕微鏡のプローブなどとしての開発が進められている.このように炭素は材料として電気的・熱的にすぐれた性質をもち,ほかの材料では代替しがたいさまざまな用途をもっている.[CAS 7440-44-0]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「炭素」の意味・わかりやすい解説
炭素【たんそ】
→関連項目黒鉛|銑鉄|ニューカーボン|有機塩素化合物
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「炭素」の意味・わかりやすい解説
炭素
たんそ
carbon
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「炭素」の解説
炭素
関連語をあわせて調べる
ちらりと見せること。特に、ファッションで、肌や肌着などを少しだけ見せる着こなしのこと。...