翻訳|nitrogen
精選版 日本国語大辞典 「窒素」の意味・読み・例文・類語
ちっ‐そ【窒素】
日本大百科全書(ニッポニカ) 「窒素」の意味・わかりやすい解説
窒素
ちっそ
nitrogen
周期表第15族に属し、窒素族元素の一つ。
歴史
古くから元素と考えられていた空気が、元素ではないということが明らかにされてきた18世紀、イギリスのD・ラザフォードは1772年、木炭やろうそくを瓶の中で燃やしたとき固定空気(二酸化炭素)ができること、これを除いても、なおあとに気体が残り、この気体が空気と違って燃焼を支持しないことを知り、有毒気体noxious airとよび、フロギストンの飽和した気体であるとした。1789年フランスのラボアジエは、フロギストンを否定するとともに空気から酸素を除いた気体の中では呼吸ができないことから、否定を意味するaと、生命を保持することを意味するzotikosとによってazoteとした。そのドイツ語訳がstickstoff(息が詰まる物質)である。日本語の窒素は文字どおりの意味(窒息)に基づいている。同じころフランスのシャプタルJean Antonie Chaptal(1756―1832)は、カ性カリの存在下、この気体と酸素を火花によって反応させると硝石の原料が得られることから、硝石を意味するラテン語nitrumと、生じるを意味するギリシア語gennaoとによってnitrogèneという名称を提案しており、これから英語のnitrogenという語が生じた。
[守永健一・中原勝儼]
存在
宇宙では五番目に多い元素で、恒星のエネルギーサイクルに含まれる。宇宙空間にもN2、NH、CN、NO、NH3などの分子の存在が示されている。地球大気中の成分としてはもっとも多く、体積で約78.1%、重量では約75.5%に達する。ほかに微量のアンモニア、アンモニウム塩、さらに空中放電や自動車の排気ガスなどによって生じた窒素酸化物と硝酸塩が大気に含まれている。土壌にも1%足らず、主として硝酸塩として存在する。窒素は生物にとって必須(ひっす)の元素であり、動植物中には平均して約16%、海水にも微量の窒素が含まれている。自然界における窒素は、空気中の気体窒素をはじめとし、アンモニア、硝酸などからタンパク質、核酸にわたって、構造の簡単なものから複雑なものまで多数の化合物として存在し、生体に深い関係をもって循環している。すなわち、土壌中の簡単な窒素化合物は植物によってタンパク質その他の複雑な化合物となり、動物が植物を摂取することによって動物の構成物質となる。さらに、動植物の死骸(しがい)や排出物のタンパク質は腐敗微生物によって還元され、ふたたび植物体内に吸収される。
[守永健一・中原勝儼]
製法
工業的には、空気を液化した液体空気から酸素とともに分留して取り出す方法が広く用いられている。実験室では、亜硝酸アンモニウム濃溶液、または塩化アンモニウムと亜硝酸ナトリウムとの混合物を約70℃に熱する。市販品は液体窒素としてタンクローリーあるいはボンベ入り(ボンベの色はねずみ色)で取り扱われる。純度99.9%で、通常の目的にはそのまま使用できる。
空気中の窒素を分離、固定し、アンモニア、硝酸をはじめとする各種の窒素化合物をつくる工業を窒素工業という。窒素の鉱物資源としては硝石およびチリ硝石NaNO3が有名であるが、19世紀の終わりごろ空中窒素固定法が発明され、これらの工業的価値は少なくなり、窒素工業は空中窒素固定工業を意味するようになった。
[守永健一・中原勝儼]
性質
無色、無味、無臭の気体。沸点は酸素より低く、融点は高い。液体、固体でも無色。つねに二原子分子として存在する。酸素よりもやや水に溶けにくい。結晶は零下238~零下210℃では六方晶系、零下238℃以下では立方晶系で、窒素分子N2がほぼ立方最密充填(じゅうてん)構造をとっている。常温では化学的に不活発である。そのため常温で窒素と直接反応するのは金属リチウム、窒素固定酵素をもつバクテリアや少数の金属錯体だけである。燃焼を支えず、呼吸を助けないが有毒ではない。高温では他の元素と直接化合し、アンモニア、酸化窒素など多くの窒化物をつくる。放電管に窒素を通して放電すると、きわめて反応性の高い窒素が得られ、活性窒素とよんでいる。放電を止めてからも黄色の残光が短時間みられる。これは普通の窒素分子のほかに原子状の窒素が存在し、残光は窒素原子の再結合で生じる窒素分子の励起状態に起因するものである。
[守永健一・中原勝儼]
窒素の化合物
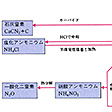
窒素は各種の型の化合物をつくり、そのなかでの酸化状態は-Ⅲから+Ⅴまでのすべてをとるが、共有原子価は3価である。たとえば、酸化数-Ⅲ(アンモニア)、-Ⅱ(ヒドラジン)、-Ⅰ(ヒドロキシルアミン)、+Ⅰ(次亜硝酸)、+Ⅱ(一酸化窒素)、+Ⅲ(亜硝酸)、+Ⅳ(二酸化窒素)、+Ⅴ(硝酸)などがあげられる。アンモニアの水素をアルキル基またはカルボキシ基(カルボキシル基)その他で置換すると、アミン類、アミノ酸など多種多様な含窒素有機化合物が誘導される。金属で置換すると金属アミドから窒化物までが導かれる。酸素との一連の化合物も大気中に含まれ酸性雨や大気汚染の原因となる。空気中の窒素と酸素の反応は温度が高くなると急激に進むようになる。燃料が何であっても、燃焼装置をくふうしても、酸化窒素の生成は避けられない。自動車の排ガス中には、窒素、酸素、水蒸気、二酸化炭素、水素が主成分として存在し、一方、一酸化炭素、一酸化窒素、アルデヒド、ケトン、各種炭化水素、スズ、鉛や炭素の微粒子などが微量成分として含まれている。燃焼に際して発生した一酸化窒素は、紫外線による光化学反応で二酸化窒素に変わり、特定な波長の光を吸収してふたたび解離し、生じた反応活性な酸素によりオゾンを生成するという。このようにして生じたオゾンを主成分とする、二酸化窒素やアルデヒド過酸化物などの酸化性物質の混合物をオキシダントと総称している。窒素化合物間の関係についてはを参照。
[守永健一・中原勝儼]
用途
水素と反応させてアンモニアをつくるアンモニア合成にもっとも多く用いられる。アンモニアから硝酸、肥料、染料など多くの窒素化合物がつくられる。窒素が化学的に不活性であることから、鉄鋼などの金属精錬をはじめとして化学工業、食品工業、電子工業などで酸化防止用封入ガス、電球封入ガスなどとして広く、また大量に用いられる。液体窒素は食品の急速冷凍用、土木用凍結剤、低温微粉砕用その他各種の目的に対応して安全な寒剤として広く用いられる。
[守永健一・中原勝儼]
窒素(データノート)
ちっそでーたのーと
窒素
元素記号 N
原子番号 7
原子量 14.0067
融点 -209.86℃
沸点 -195.8℃
比重 液体,0.808(測定温度-196℃)
固体,1.026(測定温度-252℃)
密度 気体,1.2506g/dm3(0℃,1気圧)
結晶系 α:立方
β:六方
γ:正方
溶解度 2.942mg/100g(水0℃)
1.216g/100g(水100℃)
臨界温度 -147.2℃
臨界圧 33.5気圧
元素存在度 宇宙 2.44×106(第5位)
(Si106個当りの原子数)
地殻 20ppm(第31位)
海水 0.15×106μg/dm3
改訂新版 世界大百科事典 「窒素」の意味・わかりやすい解説
窒素 (ちっそ)
nitrogen
周期表第ⅤB族に属する窒素族元素の一つ。18世紀後半にフロギストン説が否定され,酸素が発見されるとともに,空気中に存在する呼吸や燃焼に関与しない気体として発見された。フランスのA.L.ラボアジエはこれを〈生命を保持しない〉という意味のギリシア語azōtikosからフランス語でazoteと名づけたが,後にフランスのシャプタルJ.A.Chaptalは〈硝石をつくるもの〉という意味からnitrogèneという名称を提案し,これから英名が生じた。天然には主として二原子分子N2の気体として存在し,大気中の容積の約78%(重量で約75.5%)を占める。化合物として,海水中に10⁻5%,花コウ岩中に10⁻2%含まれ,生物体のタンパク質中(人体で3%)などにも広く存在する。窒素を含む鉱物にはチリ硝石NaNO3がある。
性質
無色無臭の気体。窒素分子の解離熱は225.1kcal/molできわめて大きく,常圧で3000℃に熱しても解離は認められず,化学的にきわめて不活性である。室温で窒素N2が反応するのは窒素固定酵素をもつバクテリア中で反応する場合など,ごくわずかである。高温では反応性が増し,たとえば水素との反応
N2+3H2─→2NH3
は触媒の存在で1000℃,500気圧で起こり,重要な化学工業原料であるアンモニアNH3の工業的製法である(ハーバー=ボッシュ法)。ほかに高温では
N2+CaC2─→C+CaCN2
N2+O2─→2NO
N2+3Mg─→Mg3N2
などの反応も知られている。窒素ガス中で放電すると活性窒素を生ずる。これは主として解離窒素原子から成り,放電を停止すると黄金色の光(残光)を放ちながらN2分子に戻る。この活性窒素は化学的な反応性が高い。
アルカリ金属ではリチウムだけが高温で反応して窒化リチウムLi3Nとなる。ホウ素,アルミニウム,ガリウム,インジウム,アルカリ土類金属や多くの遷移金属,希土類元素とも窒化物をつくるが,このうちBN,AlN,GaN,InNなどは共有結合性であり,TiN,VN,Mo2N,UNは金属性の侵入型と呼ばれる窒化物であり,窒化物イオンN3⁻を含まない。水素との化合物としてはアンモニアNH3をはじめとして,金属アミドMⅠNH2,金属イミドMⅠ2NH,有機化合物としては第一アミンNH2R,第二アミンNHR2,第三アミンNR3,アンモニウム塩NH4X,アルキルアンモニウム塩[NH3R]X,[NH2R2]X,[NHR3]X,[NR4]X,アミノ酸NH2RCOOH,ピリジンC5H5Nなどがある。そのほか,アジ化物MⅠN3,ヒドラジンN2H4やその誘導体,ヒドロキシルアミンNH2OHとその誘導体などがある。
窒素の同位体15Nは天然の窒素中に1/272含まれるが,これは次の反応によって選択的に硝酸中に濃縮できることが知られている。
15NO(気)+H14NO3(液)─→14NO+H15NO3(液)
得られたH15NO3は15Nで標識した窒素化合物(放射性トレーサー)をつくるために用いられる。
製法
工業的には,液体空気を分留して酸素などの他の成分から分離して得ている。含まれる微量の酸素を取り除くには,白金触媒を用いて少量の水素と反応させるか,熱した金属(銅など)の上を通して金属酸化物とするか,Cr2⁺やV2⁺の含む水溶液を通して反応させるなどの方法がある。こうして得られた窒素ガスは150気圧で高圧ガス容器(ボンベ)に入れて市販される(ボンベの色は灰色)。大量に扱う場合は断熱圧力容器中に液体窒素として貯蔵され,これを気化して窒素ガスとして使用する場合もある。
実験室で窒素ガスを発生させるには,亜硝酸ナトリウムNaNO2,亜硝酸アンモニウムNH4NO2などの濃水溶液を70℃に熱する。またアジ化ナトリウムNaN3を熱分解すると,分光学的に純粋な窒素ガスを得ることができる。
2NaN3─→2Na+3N2
用途
鋼の表面にアンモニアまたはシアン化合物を高圧で作用させることにより硬度の高い窒化物の層をつくって表面硬度を増加させる方法がエンジンシリンダーなどに広く用いられている(〈窒化〉の項参照)。窒化物のあるものは高温における耐酸性,耐衝撃性に優れ,ニューセラミックス材料として盛んに研究されている。たとえば窒化ケイ素は熱衝撃抵抗,耐酸化性,耐食性に優れ炉材用原料として,立方晶窒化ホウ素は高い硬度と耐摩耗性から高速切削用セラミックス工具として用いられている。サイアロンSialon(商標)と呼ばれる,ケイ素,アルミニウム,酸素,窒素をさまざまな比率で含む酸窒化物系セラミックスは,高温強度,耐酸化性,耐クリープ性,耐熱衝撃性が高く,ガスタービン,ディーゼルエンジン,ジェットエンジン部品あるいは高速回転用ボールベアリング材料として研究が進められている。
液体窒素
液化した窒素をいう。純粋な液体窒素は,無色透明。空気を液化して液体空気とし,これを精留して酸素,アルゴン,二酸化炭素などを除き,再び液化して,工業的に大量につくられている。低温で気化するので,貯蔵や取扱いには断熱容器,多くデュワー瓶が用いられる。低温を得るための冷却用として広く用いられ,液体酸素や液体空気と違って有機物その他が投入されても爆発性がないので,科学実験用,各種工業,医療用その他における冷却剤としての使用に便利である。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「窒素」の解説
窒素
チッソ
nitrogen
N.原子番号7の元素.電子配置1s22s22p3の周期表15族元素.原子量14.0067(2).質量数14(99.636(20)%)と15(0.364(20)%)の2種の安定同位体と,質量数10~25の放射性核種が知られている.1772年,D. Rutherfordによって発見された.K.W. Scheele(シェーレ),H. Cavendish(キャベンディッシュ),J. Priestley(プリーストリー)も,ほぼ同時期に脱フロギストン化空気として存在を認めていた.1789年,A. Lavoisier(ラボアジエ)は,この気体が呼吸を維持しないことから,ギリシア語の“生きる”ζ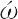 ω(zoo)と否定接頭語α(a)を合わせてazoteとよび,現在のフランス語元素名となっている.英語名nitorgenは,J.A. Chaptalが1790年,硝石(saltpeter)を意味するギリシア語の“ソーダ”νιτρον(nitron)と“造る”γεινομαι(geinomai)からnitrogèneとよんだことにもとづく.蘭学者・宇田川榕菴は,「舎密開宗」(天保8年,1837年)で,窒素瓦斯(スチッキストフガス,阿曹知究母(アソーチキュム),サルペートルストフガス,ニトロゲニウム)と記しており,ドイツ語名Stickstoff,オランダ語名stikstof“窒息させる物質(素)”を意訳したものと思われる.
ω(zoo)と否定接頭語α(a)を合わせてazoteとよび,現在のフランス語元素名となっている.英語名nitorgenは,J.A. Chaptalが1790年,硝石(saltpeter)を意味するギリシア語の“ソーダ”νιτρον(nitron)と“造る”γεινομαι(geinomai)からnitrogèneとよんだことにもとづく.蘭学者・宇田川榕菴は,「舎密開宗」(天保8年,1837年)で,窒素瓦斯(スチッキストフガス,阿曹知究母(アソーチキュム),サルペートルストフガス,ニトロゲニウム)と記しており,ドイツ語名Stickstoff,オランダ語名stikstof“窒息させる物質(素)”を意訳したものと思われる.
空気の78.084(4)%(体積)を占める.オーロラの多彩な色彩は,高層の窒素の発光による.火星の大気は95.7% が二酸化炭素で,窒素は2.7%.鉱物,生体の重要な成分元素.工業的には,液体空気の分留により得られる.実験室では,アジ化物の熱分解,亜硝酸アンモニウム水溶液の加熱で容易に得られる.無色,無臭の気体.融点63.29 K,沸点77.355 K.三重点63.151 K.臨界定数126.192 K,3.3958 MPa,0.313 g cm-3,液体は無色透明,固体は白色.密度0.870 g cm-3(液体,三重点),1.026 g cm-3(固体,21 K).水に難溶.室温では化学的に不活性である.加熱するとマグネシウム,リチウム,カルシウムなどと直接化合して窒化物をつくる.酸素との混合気体に放電すれば一酸化窒素,さらに二酸化窒素をつくる.触媒上で水素と加熱するとアンモニアとなる.アンモニア,硝酸などの原料.半導体などの製造の際のパージ・キャリヤーガスや,溶接など金属加工の際の不活性雰囲気として,また液体窒素は冷媒として食品凍結加工などに使用される.排水基準(水質汚濁防止法)アンモニア,アンモニウム化合物,亜硝酸化合物および硝酸化合物として100 mg L-1 以下.飲料水質基準では,亜硝酸態窒素と硝酸態窒素を合わせて10 mg L-1 以下.窒素は富栄養化現象の原因物質の一つで,総窒素量の限界値は0.15~0.2 mg L-1 程度とされている.[CAS 7727-37-9]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「窒素」の意味・わかりやすい解説
窒素
ちっそ
nitrogen
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「窒素」の意味・わかりやすい解説
窒素【ちっそ】
→関連項目石灰窒素
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「窒素」の解説
窒素
関連語をあわせて調べる
ちらりと見せること。特に、ファッションで、肌や肌着などを少しだけ見せる着こなしのこと。...