精選版 日本国語大辞典 「平衡定数」の意味・読み・例文・類語
へいこう‐ていすうヘイカウ‥【平衡定数】
化学辞典 第2版 「平衡定数」の解説
平衡定数
ヘイコウテイスウ
equilibrium constant
平衡状態にある化学反応系において,個々の反応物質および生成物質の濃度(あるいは分圧)を関係づける定数.一般に,
aA + bB + … = l L + mM + …
の化学平衡において,各物質の濃度を cA,cB …;cL,cM,…とするとき,
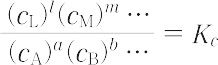
の比は一定温度では一定であり,Kc を濃度平衡定数という.また,気相反応において各物質の濃度cのかわりに分圧pを用いたとき,上式に対応する式で表される定数 Kp を圧平衡定数という.Kc,Kp を総称して平衡定数という.慣例として,左辺(反応物質)の諸量を分母に,右辺(生成物質)の諸量を分子にとる.気相反応において Kc と Kp の間には,
Kp = Kc(RT)Δn
Δn = (l + m + …) - (a + b + …)
の関係がある.ここで,Rは気体定数,Tは絶対温度である.上記の Kc,Kp を与える式は,平衡状態においては反応をわずかに右へ進行させても全系の自由エネルギーは不変であることから,熱力学的に導くことができる.[別用語参照]質量作用の法則
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「平衡定数」の意味・わかりやすい解説
平衡定数
へいこうていすう
equilibrium constant
化学反応が平衡に達したとき、原系と生成系との量的関係を示す定数。次のような化学反応
aA+bB+cC+……
 lL+mM+nN+……
lL+mM+nN+……
の平衡では、質量作用の法則が適用され、それぞれの濃度(正しくは活動度)の間には
が成り立ち、Kは温度さえ一定ならば濃度によらない一定値となる。このKを平衡定数という。
平衡定数は温度が一定ならば変わらないが、温度を変えると、絶対温度Tの関数
で示されるように変化する。ここでRは気体定数、ΔHは反応熱である。この関係から、発熱反応(ΔH<0)では温度を上げるとKが減少、すなわち平衡は左に偏り、吸熱反応(ΔH>0)では右に偏ることがわかる。
[戸田源治郎]
法則の辞典 「平衡定数」の解説
平衡定数【equilibrium constant】
aA+bB+… &lrarrow; pP+qQ+…
なる化学平衡において,各物質の濃度をCA,CB,…,CP,CQ,…としたとき
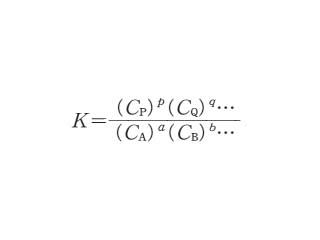
を平衡定数(濃度平衡定数)という.正確には活量濃度を用いる必要がある.この式の右辺は「濃度商」とも呼ばれる.気体反応の場合には CA,CB,…の代わりに分圧 pA,pB,…を用いると「圧平衡定数」が得られる.こちらは無次元の量である.
平衡定数【equilibrium constant】
百科事典マイペディア 「平衡定数」の意味・わかりやすい解説
平衡定数【へいこうていすう】
→関連項目化学平衡
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「平衡定数」の解説
平衡定数
ブリタニカ国際大百科事典 小項目事典 「平衡定数」の意味・わかりやすい解説
平衡定数
へいこうていすう
「質量作用の法則」のページをご覧ください。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内の平衡定数の言及
【化学反応】より
…化学反応, aA+bB+……⇄pP+qQ+……に対して,化学平衡の条件dG=0から,化学平衡に達したとき濃度比,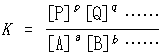 は与えられた条件のもとで一定となることが示される。Kを平衡定数と呼び,この関係を質量作用の法則あるいは化学平衡の法則という。反応の標準自由エネルギー変化⊿G0は平衡定数Kと次の関係, ⊿G0=-RTlnKがある。…
は与えられた条件のもとで一定となることが示される。Kを平衡定数と呼び,この関係を質量作用の法則あるいは化学平衡の法則という。反応の標準自由エネルギー変化⊿G0は平衡定数Kと次の関係, ⊿G0=-RTlnKがある。…
【化学平衡】より
…化学平衡に達したとき,反応系の初めの組成によらず次の平衡濃度の比 は温度のみによる定数となる。これを平衡定数という。この関係は〈質量作用の法則〉と呼ばれ,1864年C.M.グルベルグとP.ボーゲにより反応速度に基づく考察から提出され,J.H.ファント・ホフにより一般化され,熱力学に基づいて証明された。…
は温度のみによる定数となる。これを平衡定数という。この関係は〈質量作用の法則〉と呼ばれ,1864年C.M.グルベルグとP.ボーゲにより反応速度に基づく考察から提出され,J.H.ファント・ホフにより一般化され,熱力学に基づいて証明された。…
【質量作用の法則】より
…物質A(amol),B(bmol),……が反応して,M(mmol),N(nmol),……を生成する次のような反応 aA+bB+……⇄mM+nN+……が化学平衡に達したとき,各物質i(i=A,B,……)の濃度Ciの間に次の関係が成り立つ。 ここでKは温度,圧力に依存するが,濃度にはよらず,平衡定数と呼ばれる。化学平衡において一般に成り立つこの関係(1)を質量作用の法則という。…
ここでKは温度,圧力に依存するが,濃度にはよらず,平衡定数と呼ばれる。化学平衡において一般に成り立つこの関係(1)を質量作用の法則という。…
※「平衡定数」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
[名](スル)二つ以上のものが並び立つこと。「立候補者が―する」「―政権」[類語]両立・併存・同居・共存・並立・鼎立ていりつ...


 の関係が成り立つ。これを質量作用の
の関係が成り立つ。これを質量作用の