翻訳|gas
精選版 日本国語大辞典 「気体」の意味・読み・例文・類語
き‐たい【気体】
改訂新版 世界大百科事典 「気体」の意味・わかりやすい解説
気体 (きたい)
gas
物質の示す状態の一つで,比較的高い温度,低い圧力の場合に実現する。気態とも書く。気体は,固体や液体と違って一定の体積をもたず,容器に入れるとこれを満たし,つねにみずから広がろうとする性質をもつ。気体の密度は,固体,液体における値より小さい。また,気体は,固体,液体と違い容易に圧縮することができる。
→液体 →固体
気体に関する研究の歴史
水を熱すると水蒸気になり,冷やすと氷になることは古代人にも認識できた現象であろう。しかし,このような物質の状態変化が学問として研究されるようになったのは比較的歴史が浅く,熱学が発展し始めた18世紀半ばごろからである。当時の人々は,常温常圧で液体である物質が気化したものを蒸気と呼び,一方,常温常圧で気体である物質をガスと呼んで,両者を区別していた。しかし,研究が進むにつれて,しだいにこの区別には本質的な意味のないことがわかってきた。ガスも条件を変えると液体になることが判明したからである。すなわち,1823年にM.ファラデーは,大きな圧力をかけ圧縮すると塩素ガスが液体になることを発見し,次いで炭酸ガス,アンモニアガスの液化にも成功した。それに対し,空気,水素,ヘリウムなどのガスは,このような方法では液化されなかったので永久気体と呼ばれていた。この種の物質は,どんな条件下でも気体であると信じられたため,上記の名称がつけられたのである。
19世紀後半には,T.アンドルーズによって臨界温度の存在が発見された。どんな気体でも,温度が臨界温度より高ければいくら圧力をかけても液体にならないことがわかったのである。逆に,温度が臨界温度より低ければ,圧力をかけることによって気体を液化することができる。ちなみに,アンドルーズは炭酸ガスの臨界温度が31℃であることを見いだした。臨界温度の発見以後,かつて永久気体と呼ばれた物質でも,空気,水素などの沸点の高い気体から順次液化された。もっとも液化しにくかったのはヘリウムであるが,これも1908年,カメルリン・オンネスが液化に成功した(液化)。
一方,気体は多数の分子から構成されるという観点に立って,気体の示す諸性質を理論的に解明しようとする試みがなされてきた。これを気体分子運動論という。この理論はさらに一般化され,統計力学という一つの理論体系へと発展した。
気体の性質
気体の密度
一般に,一つの物質に注目すると,気体における密度は,固体,液体における値より小さい。固体,液体の状態では1cm3当り1022~1023個程度の分子が含まれるのに対し,気体では標準状態(0℃,1気圧)で2.8×1019個の程度である。このため,気体での分子間平均距離は固体,液体に比べて十数倍になる。その結果,気体では分子間の相互作用は小さく,分子はほとんど自由に運動していると考えてよい。分子間の相互作用が0であるような理想的な気体を理想気体という。
状態方程式
一定量の気体の圧力p,体積V,絶対温度Tの間には一定の関係が成り立つ。これを気体の状態方程式という。例えば,1molの理想気体に対する状態方程式は,
pV=RT ……(1)
と表される。ただし,Rは定数でこれを気体定数という。現実の気体でも,高圧,低温でない限り,(1)式の状態方程式が近似的に成り立つと考えてよい。しかし,一般的には,現実気体の場合,分子間の相互作用のため,(1)式に対する補正項が現れる。これらの詳細については〈状態方程式〉の項目を参照されたい。
熱膨張,拡散,熱伝導,粘性
気体の熱膨張率は,固体,液体より大きく,常温で3×10⁻3K⁻1程度である。また,気体は容易に拡散する性質をもち,異種の気体も相互に拡散し合って混合する。気体の熱伝導率は,ふつう固体,液体の値より小さい。熱伝導率および粘性率は温度とともに増加するが,圧力にはあまり依存しない。
内部エネルギー
理想気体の内部エネルギーは,体積にはよらず,絶対温度に比例する。したがって,1molの理想気体の内部エネルギーUは,
U=CvT ……(2)
と表される。ここで,比例定数Cvは,体積一定の下で1molの理想気体の温度を1Kだけ上昇させるのに必要な熱量を意味し,定積モル比熱と呼ばれる。一方,圧力一定下での同様な熱量は定圧モル比熱といい,通常Cpと書かれる。CpとCvとの間には,
Cp-Cv=R
の関係が成り立つ。これをマイヤーの関係式という。また,γ=Cp/Cvで定義されるγを比熱比といい,気体の性質を調べる際よく使われる。理想気体の内部エネルギーは,気体分子のもつ全運動エネルギーに等しいが,現実の気体では,分子間相互作用による位置エネルギーを考慮しなければならない。しかし,ふつうの状態にある気体では,この位置エネルギーは運動エネルギーに比べて十分小さいので,ほぼ(2)式が成り立つと考えてよい。定積モル比熱Cvの値は,気体を構成する分子の構造によって決まる。例えば,単原子気体(ヘリウム,ネオンなど)ではCv=3/2R,2原子気体(水素,酸素など)ではCv=5/2R,多原子気体(アンモニア,プロパンなど)ではCv=3Rとなる。ただし,これらの値は常温付近におけるもので,高温あるいは低温ではこれらの値と違ってくる場合がある。
断熱変化
熱の出入りがないようにしたときの状態変化を一般に断熱変化という。理想気体の断熱変化では,圧力p,体積Vとの間に,
pVγ=一定
の式が成立する。気体が断熱膨張すると温度が下がり,逆に断熱圧縮すると温度が上がる。電気冷蔵庫やクーラーなどは,このような気体の性質を利用している。
臨界点
温度を一定にして,気体の圧力pを体積Vの関数として図に示した曲線を等温線という。温度Tが臨界温度Tcより十分大きな場合,pとVとの関係は近似的に(1)式で与えられる。一方,T<Tcのとき気体を圧縮していくと,Vが図のVgに達したとき液化が始まり,その後は圧力が一定のまま液化が進行し,ついにはVがVlに達したとき,すべてが液体に変わる。Vl<V<Vgの範囲では気体と液体とが共存するので,これを共存状態という。温度を上げていくと,VgとVlとの差は縮まり,T=Tcに達すると両者は一致する。この点(図のC)を臨界点,また臨界点における圧力,体積をそれぞれ臨界圧力,臨界体積という(臨界状態)。
臨界点の近傍では,さまざまな物理量はそれ固有の異常性を示す。この現象を臨界現象という。例えば,T≦Tcの場合,臨界点の近くで,上述のVgとVlに対して,
Vg-Vl∝(Tc-T)β
の関係が成り立つ。上式で,定数βは臨界指数と呼ばれる量の一つで,実験的に,気体の種類によらず,ほぼ1/3に等しいことが知られている。臨界現象の究明は,近年,活発に研究が行われている分野の一つである。
→臨界現象
気体の概念の拡張
気体という概念は,いろいろな意味で拡張され使われている。例えば金属中の電子の運動を気体分子の運動になぞらえて理解しようとする場合がある。このときには電子気体とか電子ガスという概念が用いられる。また液体ヘリウム4の性質を調べる一つの模型として,相互作用の働かないボース粒子の集団を考えることがある。この体系は,理想ボース気体と呼ばれている。
執筆者:阿部 龍蔵
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「気体」の意味・わかりやすい解説
気体
きたい
gas
物質の集合状態の一つで、液体とともに流体とよばれる。それは、体積を一定に保ったまま形を変えるときの弾性すなわち剛性をもっていない。同じ流体とはいっても、気体は液体と違って自由表面をもたない。したがって気体の体積は容器の体積と一致する。気体はどのような種類のものでも、化学反応をおこす場合を別として、まったくよく混じり合い、水と油のように2相になるというものはない。それゆえ、混合気体であるか純粋気体であるかは、化学分析をしなければ区別しがたい。気体は固体や液体と比べてはるかに容易に圧縮することができる。気体の体積と圧力とは、温度を一定に保っておくと互いに反比例する(ボイルの法則)。また圧力を一定に保つと、体積は温度1℃上がるごとに、0℃のときの体積の273分の1ずつ増大する(シャルルの法則)。これを組み合わせると
pV=c(t+273)
と書ける(tは摂氏の温度)。多くの気体はだいたいこの法則に従うが、厳密に従うわけではない。厳密に従う気体を仮定して理想気体という。理想気体は実在する気体ではないが、まったくの空想的なものではない。気体のもつもっとも基本的な特徴を純粋な形で抜き出したものである。それゆえ、現実の気体はある近似でボイル‐シャルルの法則に従う。これから大きく外れるのは、たとえば液化がおこるときのように、気体が気体でなくなるときである。分子論的にいえば、分子が大きさをもたず、相互作用がなければ理想気体としてふるまうはずである。気体が、その構造上、液体や固体と違うのは、分子間の距離が分子の大きさに比べて著しく大きく、分子間の相互作用がほとんど無視できるということである。この特徴を端的に表したものが理想気体である。理想気体について、T=t+273.2という温度尺度Tを新たに導入すれば(ケルビン温度目盛)、pV=cTと書ける。さらに分子量をmとしたときmグラムの気体、すなわち1モルの気体をとれば、気体の化学的種別に関係なくcは一定の定数である。これを気体定数という。このことは、一定圧力・一定温度の下で1モルの気体は、その分子がなんであろうとも一定体積を占めるということを示している。実際に0℃で近似的に理想気体と考えてよいような酸素、窒素、水素、ヘリウムなどの気体では、1気圧で22.4リットルの体積をもつ。このことを使えば、ある温度・ある圧力の下での気体の体積をたやすく計算することができる。
現実の気体は適当な方法でそれを液化することができる。二酸化炭素(炭酸ガス)、プロパンなどは、単に圧力を加えるだけで液化されるが、酸素、窒素、水素、ヘリウムなどは、常温でどのように圧縮しても液化することができないので、かつては永久気体の名でよばれたこともあった。しかし、それらの気体も、それぞれの臨界温度以下に下げておいて圧縮すれば液化することがわかった。前記の二酸化炭素やプロパンは、その臨界温度が常温より高いので、常温で圧縮して液化することができる。それゆえ、気体にそれぞれ固有の臨界温度があることがわかれば、永久気体ということばは無意味となる。気体を十分冷却することができれば、1気圧でも液化する。1気圧の下での液化温度すなわち沸騰点のもっとも低いのはヘリウムであって、それは絶対温度4.2K(すなわちマイナス269℃)である。このような物質は広い温度範囲にわたって理想気体とみなされる。
きわめて高密度の気体は、それが自由表面をもたないことから気体とよんでもよいが、物性的には液体と考えたほうがよいともいえる。このように考えると、臨界温度以上で気体を強く圧縮すると、連続的に気体から液体へと変わったのだということもできる。
気体ということばは、いままでの説明とは違って、相互作用を無視しうるような粒子系一般に拡張しても使われる。相互作用が無視されるようなフェルミ粒子、ボース粒子の系に対して、フェルミ気体、ボース気体ということばが使われ、また金属内の伝導電子(フェルミ粒子)の多体系はしばしば電子気体とよばれる。
[宮原将平]
百科事典マイペディア 「気体」の意味・わかりやすい解説
気体【きたい】
→関連項目ガス|気体温度計|固体
出典 株式会社平凡社百科事典マイペディアについて 情報
普及版 字通 「気体」の読み・字形・画数・意味
【気体】きたい
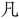 そ老を
そ老を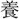 ふに、五
ふに、五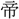 は(老に)
は(老に)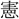 (のつと)り、三王はまた言を乞ふ。五
(のつと)り、三王はまた言を乞ふ。五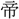 は
は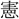 るも、氣體を
るも、氣體を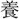 ひて、言を乞はず。
ひて、言を乞はず。字通「気」の項目を見る。
出典 平凡社「普及版 字通」普及版 字通について 情報
ブリタニカ国際大百科事典 小項目事典 「気体」の意味・わかりやすい解説
気体
きたい
gas
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
化学辞典 第2版 「気体」の解説
気体
キタイ
gas
物質の凝集状態の一つで,もっとも集合状態の粗なもの.気体は圧力および温度により容易にその体積を変化させる(圧縮率,膨張係数大).また,一定の形状をもたない点では液体と同じであるが,気体自身は表面をもたず,利用できる空間をくまなく満たす性質をもっている.分子の集合が粗なため分子間相互作用が小さく,その性質の理論的取り扱いももっとも容易である.[別用語参照]気体分子運動論
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
関連語をあわせて調べる
その議会の過半数には達しないが、議席数をもっとも多くもつ政党。...


