翻訳|solution
精選版 日本国語大辞典 「溶液」の意味・読み・例文・類語
よう‐えき【溶液】
- 〘 名詞 〙 二種またはそれ以上の物質がまじりあって均質になっている液体。溶けている物質を溶質、溶かしている液体を溶媒という。
- [初出の実例]「金、銀、
 、鉛、蒼鉛の溶液を以て」(出典:舎密開宗(1837‐47)内)
、鉛、蒼鉛の溶液を以て」(出典:舎密開宗(1837‐47)内)
- [初出の実例]「金、銀、
改訂新版 世界大百科事典 「溶液」の意味・わかりやすい解説
溶液 (ようえき)
solution
均一な液相をつくっている混合物。均一混合物には液相のほかに,気相,固相の場合がある。固相の場合は固溶体といい,液相の溶液とあわせて溶体という。溶体と同じ意味で溶液を用いることもある。溶液成分のうちの一つが他を溶かしていると考えられるとき,溶かしている成分を溶媒,溶けている成分を溶質という。溶媒,溶質がともに液体で,たとえば水とエチルアルコールのように任意の割合で混合する溶液の場合には便宜上,量の多いほうを溶媒とする。均一な液体混合物の肉眼でわかる特徴は,透明な混合物を長時間静置するか遠心分離機にかけるかしても分離が生じないこと,また透明のように見えてもその混合物を逆さまにした場合に液体の流れがみえないことである。たとえ透明でも,不均一であると各部分の密度,屈折率が異なるから逆さまにすると流れが生じ肉眼でみても流れる様子が認められる。
電解質溶液と非電解質溶液
極性溶媒に電解質が溶解し,陽イオンと陰イオンとに解離している溶液を電解質溶液またはイオン性溶液といい,電解質を含まない溶液を非電解質溶液または分子性溶液という。前者ではイオン-イオン間,イオン-溶媒間の力がおもに寄与するのに対し,後者ではふつう分子間力が支配するので,両者は異なった立場から取り扱われる。溶液中にイオンが含まれているかどうかは,溶液の電気伝導度(導電率)を測ることによって知ることができる。すなわちイオンが存在している溶液の電気伝導度はイオンを含まない溶液のそれより大きい。電解質が溶液中で解離する度合(解離度)は,電解質がイオン結合からなる場合は大きい(強電解質または〈真の電解質true electrolyte〉)。しかしイオン結合性ではない物質でも,溶媒との相互作用により,部分的にイオンとなりうる可能性を有する場合がある(弱電解質または〈潜在的な電解質potential electrolyte〉)。
溶液の熱力学的性質
非電解質溶液ではその成分の組合せによって異なった性質を示すが,ふつう次のような相互作用の立場から論じられる。
(1)理想溶液ideal solution 混合した場合に,熱変化や体積の変化がない仮想的な溶液である。すべての溶液はその濃度が十分に希薄な場合に理想溶液に近い性質を示す。しかし溶質と溶媒の分子の大きさが等しい場合や化学的によく似ている場合(たとえば同位体混合物とか,クロロベンゼンとブロモベンゼンとの混合物など)は,単に濃度が希薄な場合だけでなく,すべての濃度範囲においてこの溶液は理想溶液に近い性質を示す。このような溶液を完全溶液perfect solutionという。理想溶液を定義する場合に熱力学的な表現を用いると次のようになる。成分1,2,……,iからなる溶液の内部エネルギーをUとし,それぞれの成分のモル数をn1,n2,……,ni,内部エネルギーをU1,U2,……,Ui(以下のHi,Vi等についても同様)とすると,内部エネルギー変化⊿Uは0である(⊿U=0)。すなわちU=ΣniUi。同様に混合熱が0である(⊿H=0)から系のエンタルピーHはH=ΣniHiである。また混合の体積変化が0(⊿V=0)であるから系の体積VはV=ΣniViとなる。別な表現をすれば,各成分のそれぞれの値Ui,Hi,Viと系全体の量U,H,Vとの間には加成性が成り立つといえる。すなわちモル数をかけた項,たとえばn1U1,n2U2,……,niUiの単なる加算で系の全体の量,たとえばUが表される。さらに混合のエントロピー変化⊿Sは,理想気体における場合と同様に,⊿S=-RΣnilnxiで表される。ここでRは気体定数,xiはi成分のモル分率である。またギブズの自由エネルギーを成分1mol当りの量と定義した化学ポテンシャルμiはμi=μi°(T,P)+RTlnxiで表される。ここでμi°(T,P)は温度T,圧力Pにおける純粋なi成分(すなわちxi=1)の化学ポテンシャルである。以上いくつかの式で理想溶液の特徴を表したが,非理想溶液つまり希薄溶液以外の大部分の実在溶液においてはこれらの式でそれぞれの熱力学的な量を表すことはできず,その場合は各式になんらかの補正を加える必要がある。
→活動度
(2)無熱溶液athermal solution いくつかの成分が混合によって溶液となるさいに,熱の出入りがなく(混合熱が0,すなわち⊿H=0),そのうえ混合のエントロピー変化が理想溶液における値と異なる(⊿S≠-RΣnilnxi)溶液をいう。理想溶液の場合と異なり,成分の分子の相互作用が非常に似ているにもかかわらず,大きさが異なる場合に無熱溶液となる。たとえば臭化エチレンと臭化プロピレン溶液などがその例である。
(3)正則溶液regular solution いくつかの成分を混合して溶液をつくるさいに,熱の出入りがあり(混合熱が0ではない。⊿H≠0),しかも混合のエントロピー変化が理想溶液の場合と同じ(⊿S=-RΣnilnxi)である溶液をヒルデブランドJ.H.Hildebrandは正則溶液と定義した(1929)。実在溶液を扱うさいに,化学的な相互作用,会合などの分子間相互作用がない溶液については,この定義による条件を近似的に満たす場合が多く,ベンゼンと四塩化炭素とからなる溶液はその例である。
(4)高分子溶液polymer solution 溶質が高分子化合物である溶液。溶媒が水である場合は水溶性高分子溶液water-soluble polymer solutionという。低分子化合物の溶液の性質とは異なる傾向の物理的性質(熱力学的性質としては蒸気圧降下,浸透圧,凝固点降下など,輸送現象などに関する性質としては粘性,拡散,沈降など,光学的性質としては流動複屈折,光散乱など)がみられる。
(5)界面活性剤溶液surfactant solution ある種の物質(たとえばアルキルベンゼンスルホン酸ナトリウム)を液体に溶かすと,その溶液の表面張力が著しく減少する。このような物質を界面活性剤という。また界面活性剤は溶液中である濃度(臨界ミセル濃度)以上になるとミセル(多数の分子が分子間力で会合して生じた親液コロイド粒子)を形成するという特徴がある。水に不溶性の液体や固体が界面活性剤のミセル溶液中に溶け安定な溶液を生ずる現象を可溶化solubilizationまたは溶解化といい,このような溶液を可溶化溶液solubilized solutionという。
なお,低融点の合金や常温においては固体であるが高温で融解した状態では液体または溶液となるものに溶融塩と液体合金がある。溶融塩(融解塩)fused saltは電解質を加熱して融解し,液体状態にした混合系で,イオン伝導,電気分解などの現象を示し,この系も一種の電解質溶液とみなすことができよう。液体合金liquid alloyは低融点の金属,合金を溶融したもの。たとえばナックと呼ばれるカリウム-ナトリウム合金は融点-12.5℃で,原子炉冷却材として用いられている。最近は低融点合金のみでなく高融点の各種の合金溶液についても研究が進み実用にも供されている。
溶液の性質
溶液の性質は平衡状態における性質と非平衡状態における性質に大別される。(1)平衡状態における性質 換言すれば熱力学的性質である。溶液の性質を調べるさいには温度,圧力などの必要な条件を一定に保ち,変化がもはや生じない状態,すなわち平衡に達した状態において行う。具体的には,蒸気圧降下,沸点上昇,凝固点降下,浸透圧などである。これらの現象は溶液では一般にみられるが,とくに希薄溶液においてのそれらの変化量は,溶媒が決まっていれば,溶質の種類によるのではなく,どれだけの量(モル数)の溶質が単位量の溶媒に溶けているかで決まることが実験的にも確かめられており,さらに熱力学的にも証明される。したがって,このような物質の種類によらない不揮発性物質の希薄溶液の性質を束一的性質colligative propertyという。これらの束一的性質を利用して分子量を求めることが可能である。濃度が希薄であると限る理由は,これらの束一的性質が〈ラウールの法則〉(蒸気圧降下に関する法則)やその法則に関連する沸点上昇,凝固点降下についての式から得られる計算値と実測値が一致するのは濃度が希薄な場合のみであるということである。濃度が高くなれば実測値を理論的に説明することは困難になる。気体,液体,蒸気圧の高い固体などの気体あるいは気体になりやすい物質の溶液を扱うさいには,溶質の蒸気圧(分圧)を考慮しなければならない。溶媒に気体が溶解して溶液を生ずる場合の,その気体の分圧と溶解度との関係は〈ヘンリーの法則〉として知られている。天然物からある成分を抽出したり,化学分析や合成のさいに用いられる物質の分離や精製の操作の一つの溶媒抽出solvent extractionは,2溶媒間におけるある物質の存在量に関するネルンストの分配律の応用である。(2)非平衡状態における性質 拡散,粘性,電気伝導などに関する性質である。溶液中の溶質や溶媒の拡散,溶液の粘性や電気伝導に関する性質についても実験的,理論的に研究がなされている。
執筆者:橋谷 卓成
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「溶液」の意味・わかりやすい解説
溶液
ようえき
solution
液体に固体、液体、気体が溶解して均一になった液体をいう。ときには固溶体を含めることもある。
溶質と溶媒
溶液では、溶けている物質を溶質とよび、溶かしているほうは溶媒という。液体どうしの混合の場合などにはどちらが溶媒かを区別しにくいこともある。この場合、分量(分子数)の多いほうが溶媒、少ないほうを溶質とする。清酒などではアルコールが溶質であるけれども、局方アルコール(96%)の場合は、アルコールのほうが溶媒で水が溶質ということになる。
[山崎 昶]
水溶液
水はきわめて優れた溶媒であり、大多数の塩類や親水性基をもつ有機化合物(ショ糖やせっけんなど)までよく溶解する。このように溶解性に優れているのは、水の誘電率が80と大きいので、イオンが結晶中でクーロン引力で引き合っている力が80分の1に下がることと、水分子との水素結合や水和などによって溶質の分子やイオンは引き離されて安定に存在できるからである。エタノール(エチルアルコール)のように誘電率が小さくなるとイオン性結晶の溶解性は格段に悪くなる。
[山崎 昶]
溶解性
「類は類を溶かす」というのが溶解性の予測によくいわれることである。前述の水溶液のように極性の大きい溶媒には、やはり極性の大きい溶質が溶けやすい。一方、石油エーテルやベンゼンのように極性の低い溶媒には極性の小さい溶質が溶けやすく、極性の大きい溶質(たとえば水)などはほとんど溶解しない。このような溶解性の差を利用したのが液液抽出(溶媒抽出)である。有機化合物の場合は紀元前から香料などの抽出に応用されてきたが、無機化合物に応用されたのは、1842年フランスのペリゴーが硝酸ウラニルをエーテル抽出したのに始まる。しかし溶媒抽出の応用が盛んになったのは、第二次世界大戦中のマンハッタン計画などのウランやトリウムなどの核燃料精製・分離に応用されて、研究が進んだことによる。ウランやトリウムの配位した水分子を、リン酸トリブチルのような有機化合物で置き換えて、有機溶媒に対する親和性を増大させることによって、水相から有機相に抽出することが容易になる。
化学構造のよく似た物質どうしはよく混合しあうが、異なり方の大きいものはほとんど溶解しあわない。たとえば水銀は、金属結合でできているので、水のような極性物質、ガソリンのような無極性溶媒とも混じらない。しかしほとんどの金属とはアマルガムをつくる。
[山崎 昶]
溶解度と溶解熱
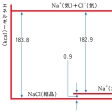
水とエタノールのように、どんな割合にでも溶解しあう場合はどちらかといえば珍しく、一般には溶質が溶媒に溶けるには限度があり、この限度は温度によって定まる。気体ではヘンリーの法則が、あまり溶解度の大きくないものについては成立し、圧力に比例して溶解量が増大する。溶質の溶解時に吸熱や発熱がおこるが、これらは溶解熱と総称する。これは、通常は溶質の結晶から溶質分子(またはイオン)を取り出すのに必要な格子エネルギーと、溶媒中でこれらの分子やイオンが溶媒和によって安定化するエネルギーとの差にあたる。塩化ナトリウムの格子エネルギーは1モル当り183.8キロカロリーであるが、溶媒和の安定化エネルギーが182.9キロカロリーもあり、差し引きわずかに0.9キロカロリーが溶解熱ということになる。このように溶解熱が小さいから、塩化ナトリウムの溶解度は温度によってあまり変化しないのである。
[山崎 昶]
凝固点降下と沸点上昇
溶液の性質は、純粋な溶媒の性質とかなり異なる。そのなかで顕著なものとして、溶媒よりも溶液の蒸気圧は低下するために沸点は上昇するし、凝固点は降下する。この沸点上昇、凝固点降下は溶質の濃度(分子数)に比例するから、これを利用して溶質の分子量や電離度などを測定することもできる。1モルの溶質が1キログラムの溶媒に溶けている場合の沸点上昇、凝固点降下は、それぞれモル沸点上昇、モル凝固点降下という。水の場合それぞれ0.52℃、1.86℃である。分子量測定などには樟脳(しょうのう)やスルホランのようにモル凝固点降下の大きいものを溶媒として行うことが多い。
[山崎 昶]
溶液論
溶液のもついろいろな性質を熱力学や統計力学、量子力学などの見地から解明するものである。希薄溶液についての諸法則(ラウールの法則や、ファント・ホッフの浸透圧の法則、ヘンリーの法則、分配律)などは分子論的に、また統計力学的に基礎づけが成功した。これに比べると、濃厚溶液に関しては、デバイ‐ヒュッケルの理論などがあるが、まだ種々の困難な点もあり、完全な理論はまだ完成に至っていない。
[山崎 昶]
『篠田耕三著『溶液と溶解度』(1966・丸善)』▽『篠田耕三編『合成と溶解のための溶媒』(1969・丸善)』
ブリタニカ国際大百科事典 小項目事典 「溶液」の意味・わかりやすい解説
溶液
ようえき
solution
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「溶液」の意味・わかりやすい解説
溶液【ようえき】
→関連項目過飽和|溶解
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「溶液」の解説
溶液
ヨウエキ
solution
液体状態にある均一な混合物をいう.気体または固体が液体とまじって溶液をつくる場合,その気体または固体を溶質といい,液体のほうを溶媒という.液体と液体の混合の場合は,多量に存在するほうを溶媒とみなす場合が多い.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
普及版 字通 「溶液」の読み・字形・画数・意味
【溶液】ようえき
字通「溶」の項目を見る。
出典 平凡社「普及版 字通」普及版 字通について 情報
栄養・生化学辞典 「溶液」の解説
溶液
世界大百科事典(旧版)内の溶液の言及
【液体】より
…液体のこの二面性は今日の液体像の根幹である。
[液体の分類]
液体が化学的に単一な物質よりなっているとき,これを純液体または単に液体と呼び,2種類以上の物質からなる場合を溶液と呼んでいる。また,中性の分子からできている液体は分子液体と呼ばれ,希ガス,酸素,窒素,二酸化炭素などを液化すると分子液体となる。…
※「溶液」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
[名](スル)二つ以上のものが並び立つこと。「立候補者が―する」「―政権」[類語]両立・併存・同居・共存・並立・鼎立ていりつ...