内科学 第10版 「脂質代謝総論」の解説
脂質代謝総論(脂質代謝異常)
(1)脂質代謝の流れ
脂質は,蛋白質,糖質と並んで3大栄養素の1つであり,生体にとってはきわめて重要な栄養素である.特に,トリグリセリド(triglyceride:TG,中性脂肪)の脂肪酸は重要なエネルギー源として,また,コレステロールやリン脂質は細胞骨格の一部として,さらにコレステロールは胆汁酸やステロイドホルモンなどの代謝活性物質の原料としても重要な役割を演じている.それゆえに各脂質の代謝は,きわめて巧妙にかつ緻密にコントロールされている.
これら脂質は,生体自身で合成できるとともに経口的摂取によっても賄われている.経口摂取のなかで最も多いのがTGであり,1日約50~100 gを摂取している.一方,コレステロールについては,1日300~700 mg程度であり,脂質摂取量としては格段の差がある.これは,エネルギー源としてのTGを多くは食に求めるという生物の根源的な問題がある.したがって,TGは生体に取り込まれると,ほとんどは水解されて,脂肪酸として筋肉などにおいてエネルギーとして利用される.そのほか,余剰のTGはエネルギーの貯蔵庫である脂肪細胞などに保存される.さらに過剰になれば,肝臓などにも蓄積され,脂肪肝の原因ともなる.外部へのTGとしての排泄は通常はない.一方,コレステロールは小腸から取り込まれ,トリグリセリドとともにカイロミクロン(CM)として血中に入るが,そのほとんどが肝臓に取り込まれ,肝臓でほかの脂質とともに超低比重リポ(VLDL)というリポ蛋白に取り込まれ,血中に運ばれる.血中ではVLDL中のTGが水解されて,コレステロール主体の低比重リポ蛋白(LDL)となって,各細胞表面に存在するLDL受容体を介して細胞内に取り込まれる.取り込まれたコレステロールはそのステロイド骨格を利用して,肝臓では胆汁酸に変換され,小腸へ排泄されて,消化液として利用される.副腎ではほんの少量であるがステロイドホルモンに変換され,血中で利用される.ヒトはステロイド骨格を分解することはできないため,コレステロールの生体からの排泄経路は唯一胆汁を介して小腸に排泄される.小腸には胆汁酸とともに,コレステロール自体も胆汁酸とミセルを形成して排泄される.この胆汁酸は回腸末端部で回腸胆汁酸トランスポーターという蛋白を介して能動的に再吸収され,ほぼ95%が腸肝循環すると考えられており,5%が糞便中に排泄されるにすぎない.1日に500~800 mgの胆汁酸が合成され,同量が排泄され,恒常性を保っている.一方,胆汁中に排泄されるコレステロールは1日800~2000 mgであるが,この50%以上は小腸粘膜に存在するNiemann-Pick C1 like 1 (NPC1L1)という蛋白を介して再吸収される.コレステロールの代謝の項でも触れるが,コレステロール合成には大量のエネルギーを必要とするため,生体はできるだけコレステロールを再利用することで生体機能を保とうとしている.リン脂質は,ほぼ,コレステロールと同様の動きを示し,生体膜やリポ蛋白の形成脂質として重要な役割を演じている.
(2)コレステロールの代謝
先にも触れたように,コレステロールは生体にとって,きわめて重要な分子であり,生物はこれをきわめて巧妙に利用するすべをもっている.
a.コレステロールの吸収
小腸において吸収されるコレステロールは,主として食事,胆汁コレステロールと小腸細胞の脱落という3つの起源に由来する.食事からは通常300~700 mg/日,胆汁コレステロールからは800~2000 mg/日,小腸粘膜脱落細胞からのコレステロールは約300 mg/日と推測されている.つまり,1.5~2 gくらいが小腸において吸収の対象になるコレステロール量である.
ヒトの場合,食事由来コレステロールは,いったん膵臓由来のコレステロールエステラーゼにより遊離型コレステロール(FC)になるが,胆汁中のコレステロールとともに胆汁酸によりミセル化され,小腸粘膜細胞に至る.ミセル中に存在するコレステロールは小腸粘膜細胞表面に存在するNPC1L1というコレステロールトランスポーターに特異的に認識され小腸粘膜細胞に取り込まれる.小腸に存在するコレステロールの約50%がNPC1L1経路を介して吸収されると推定されている.
小腸粘膜細胞で吸収されたFCは小腸粘膜細胞内でacyl CoA cholesterol acyltransferase(ACAT)によるエステル化を受けコレステロールエステル(CE)となってCMというリポ蛋白に組み込まれる. したがって,体内コレステロールプールへの外因性コレステロールの寄与率は,小腸粘膜でのNPC1L1を介した吸収と細胞内でのACATによるエステル化が律速段階となっていると考えられている. ACATの調節機構は十分明らかにされていないが,NPC1L1については,インスリンやコレステロールなどの制御因子が見つかっている.NPC1L1を阻害する薬剤も開発され(エゼチミブ),実際に本薬剤で血清コレステロールが低下することが明らかになっている. 食事由来コレステロールの血中コレステロールに対する寄与度は,300 mg/日くらいまでは直線的に増加することが知られている.
b.コレステロールの合成
コレステロールは細胞膜の構成成分であるとともに,胆汁酸やステロイドホルモンの前駆体でもあり,生体の機能維持に不可欠な脂質である.1日あたり食物中から300~700 mgのコレステロールが供給されるのに対し,体内で合成されるコレステロールは1500~2000 mg(肝臓では約500 mg)に及び,コレステロールプールにおける内因性のコレステロールの比率は高い.コレステロールは図13-4-1に示すように,アミノ酸や糖質合成の交差点であるアセチルCoAを起点として17段階以上のプロセスを経て合成される.コレステロール1分子の合成には,3分子のATPが必要とされエネルギー消費の高い合成系である.その律速段階となるのが3-hydroxy-3-methyl-glutaryl coenzyme A(HMG CoA)をメバロン酸に還元するHMG CoA還元酵素である.HMG CoA還元酵素は分子量約97 Kの糖蛋白であり,滑面小胞体に局在し,そのC末端が酵素活性をもつ部位で細胞質中に突き出ており,N端末には疎水性のアミノ酸が並ぶ部位と親水性のアミノ酸が並ぶ部位があり,小胞体膜を7回貫通している.
細胞内コレステロールは,コレステロール合成にネガティブフィードバックをかけ恒常性を維持している.
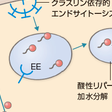
細胞内コレステロールには,de novo合成のプールとLDL受容体を介して取り込まれるコレステロールプールが存在する.LDL受容体は1973年にGoldstein, Brownにより発見された膜蛋白であり,7つの膜貫通ドメインを有する(Brownら,1976).図13-4-2に示すようにLDL受容体はアポ蛋白B(アポB)かアポEを特異的に認識し,アポBを有するLDLが細胞内へ取り込まれ,LDL中のコレステロールが利用される.細胞内に取り込まれたり,de novo合成のコレステロールが増加すると,コレステロールの合成やLDL受容体の合成が抑制され,細胞内コレステロールの恒常性は保たれる.また,LDL受容体を介したコレステロールは図13-4-3に示したようにエンドソームに取り込まれ,細胞内に流入しNiemann-Pick type C1 (NPC-1),やNPC-2の作用を受けてライソゾームに運搬されると考えられている.一方,de novo合成されたコレステロールの一部はきわめて急速に(約30分くらいとされている)形質膜に運搬され,形質膜のコレステロールとして利用される.それ以外のコレステロールは小胞体でCEとなり,最終的にはVLDLとして血中に分泌される.VLDLは血中でリポ蛋白リパーゼ(LPL)によるTGの水解・代謝を受けてLDLに変換し,各末梢臓器にコレステロールやTGを分配する役割を演ずる.このVLDLとしての分泌には,アポBの結合が必須である.アポBの結合を司る役割を演じている分子がmicrosomal triglyceride transfer protein (MTP)である.MTPの異常ではVLDLの合成ができず,無βリポ蛋白血症という先天性疾患が生ずる.
c.胆汁としての脂質排泄機構
コレステロールの胆汁への流出は,ミクロソームのFCプールにより決定されている.FCの約40%が胆汁コレステロールとして分泌され,約50%が胆汁酸に変換されて分泌される.また,胆汁中のコレステロールは胆汁酸とカップルして分泌されることから,ステロール分泌は胆汁酸の合成量に依存していることとなる.胆汁酸は図13-4-4に示すように14種の酵素によりコレステロールから合成されるが,その律速段階は7α-ヒドロキシラーゼ(CYP7A)であり,一次胆汁酸としてコール酸 (cholic acid:CA)とケノデオキシコール酸(chenodeoxy cholic acid:CDCA) が形成される.合成比率はCAが約66%を占めるとされている.小腸へ分泌された胆汁酸は,腸管内でデオキシコール酸やリトコール酸となり,腸肝循環して再吸収される.この胆汁酸合成ではCYP7Aが律速酵素であるが,CYP7Aはリガンド依存性核内受容体である肝臓X受容体(LXR),ファルネソイドX受容体(FXR)により,それぞれ促進的,抑制的制御を受けている.促進的に作用するものとしてはコレステロールやオキシコレステロールがLXRのリガンドとして作用し,抑制的にはCDCAがFXRのリガンドとして作用しており,総じて胆汁中のコレステロール量や胆汁酸の生成量を一定に保つ恒常性環境があるものと思われる.
また,コレステロールの胆汁中への排泄は図13-4-5に示すようにATP結合カセット輸送体(ABC)G5/8という輸送体を介して細胆管に分泌される.胆汁酸は胆汁酸排泄ポンプ(BSEP)で細胆管に排泄され,リン脂質は多剤耐性蛋白(MDR)3により能動的に排泄され,胆汁中の各脂質のバランスがとられている.このようにして分泌された胆汁中のコレステロールは,コレステロール吸収の項でも述べたように,小腸粘膜細胞表面に存在するNPC1L1により約50%が再吸収される.一方,胆汁酸は回腸末端に存在する胆汁酸トランスポーターにより約95%が能動的に再吸収され,5%(1日約500 mg)のみが糞便中に排泄される.再吸収されて門脈中に運搬された胆汁酸は1回の肝臓通過で80%以上が肝臓に取り込まれる.このような腸肝循環は1日に4~12回行われるといい,きわめて効率のよいコレステロール,胆汁酸の利用が行われている.
(3)トリグリセリド(TG)の代謝
先にも触れたように,脂質は重要な栄養素であり,貴重なエネルギー源である.血中脂質のなかで主たるエネルギー源はTGであり,そこから派生する脂肪酸が細胞で利用されエネルギー産生に寄与している.ヒトでは,食事中の主たる脂質はTGであり,1日50~100 gという大量のTGを摂取している.食事中のTGは,胃リパーゼや膵リパーゼの作用を受けて脂肪酸とモノグリセリドに分解されてはじめて小腸粘膜細胞に取り込まれる.TGが膵リパーゼの水解を受けるためには複合ミセル状態になっている必要があり,ここにも胆汁酸の作用が要求される.脂肪酸は,小腸粘膜細胞表面に存在する脂肪酸結合蛋白(FABP)を介して取り込まれる.
小腸粘膜では図13-4-6に示すようにモノアシルグリセロール経路とグリセロリン酸経路によりTGが再合成される.取り込まれた脂肪酸は活性化され,アシルCoAとなり,モノグリセリドに順次脂肪酸が結合してTGとなる.一方,空腹状態もしくは飢餓状態ではグリセロリン酸経路が作動し,グリセロリン酸がアシルCoAによりホスファチジン酸となり,その後,加水分解を受けてジグリセリドとなり,最終的にアシルCoAによりTGとなる.このようにして合成されたTGは最終的には先のCEやアポB48と統合されてCMとなる.食事中の脂質は大半がTGであり,それゆえにCMの90%以上はTGで占められることとなる.
CMは血中で脂肪酸を各細胞にエネルギー源として分配しながら,CMレムナント(CM-R)として肝臓に取り込まれ,その脂質は肝臓で利用されることとなるが,肝臓はde novoでも脂肪酸合成を介してTGを合成している.この脂肪酸合成にかかわる脂肪酸合成酵素(FAS)などのリポジェニックな酵素群の発現にはSREBP-1cが強く関与している.このSREBP-1cは糖質,飽和脂肪酸などの摂取やインスリン抵抗性でインスリン過剰になっていると活性化され,TGの合成を亢進させる.一方,多価不飽和脂肪酸の摂取ではSREBP-1cは抑制され脂肪酸合成は抑制される.また,SREBP-1cはオキシコレステロールがリガンドとなるLXRにより調節されており,また,不飽和脂肪酸はLXRのリガンドとなり,SREBP-1cの発現抑制を起こすという.
(4)リポ蛋白代謝
リポ蛋白はその生成ならびに機能からみて,小腸由来のリポ蛋白(CM),肝臓由来のリポ蛋白(VLDL,LDL)とコレステロール逆転送系を担う高比重系リポ蛋白(HDL)とに分けられる.リポ蛋白の分類と各々の性質を表13-4-1に示した.どのリポ蛋白もほとんどの脂質とアポ蛋白を含んでいるが,その割合が異なり,それぞれ特有の性質を示す.肝臓はVLDL,HDLの合成臓器であるとともに小腸で合成されたCMの異化臓器でもあるということから,リポ蛋白代謝のなかで最も中心的な臓器である.
a.小腸由来リポ蛋白(CM)の代謝
先にも触れたように,小腸粘膜細胞では食事中のTGやコレステロールを中心として,胆汁中のコレステロールも含めて,外因性に脂質を取り込む.これを小腸粘膜細胞で再構築して,アポB48も統合してできたものがCMである.小腸粘膜細胞から大循環への取り込みはまずリンパ管へ運搬されてから行われる.リンパ管に分泌されたCMは胸管を通り,静脈角から上大静脈内に入る.静脈へ入ったCMは図13-4-7に示したようにHDLなどのリポ蛋白からアポCⅡやアポEを獲得して,成熟化する.CMは静脈の内皮細胞表面のヘパラン硫酸プロテオグリカンに係留されているLPLの作用を受けて,TGの一部が分解され,脂肪酸を各細胞にエネルギー源として分配した後に,CM-Rになる.このLPL作用にはアポCⅡの存在が不可欠である.CM-Rは肝臓のレムナント受容体を介して取り込まれ,運命を終了する.この取り込みには,CM-R表面に存在するアポEが不可欠である.
このように,食事由来のTGは一部分解されて脂肪酸として筋肉や脂肪組織に取り込まれエネルギー源として利用されるが,その遺残物であるCM-Rは肝臓へ運搬され,食事由来脂質(TGやコレステロール)を肝臓へ届ける.この際,脂溶性ビタミンであるビタミンA,E,D,Kなども肝臓に運搬される.
b.肝臓由来リポ蛋白(VLDL,IDL,LDL)の代謝
肝細胞における脂質の由来は,先にあげた外因性脂質としてCM-Rから得る部分と,LDL受容体を介して血中から得る部分と,de novo合成のコレステロールやTGなどの脂質とからなる.これらの脂質が,アポB100と統合することにより,VLDLが形成される.この統合に与るのが先に触れたMTPである.したがって,MTP分子異常症である無βリポ蛋白血症ではCM,VLDLの合成が起こらず,結果としてLDLも欠如することとなる.
肝臓で合成分泌されたVLDLは図13-4-8に示したようにLPLの作用を受けて,脂肪酸を末梢組織に分配し,IDLもしくはVLDLレムナントとなる.IDLはさらに肝臓で合成されるhepatic triglyceride lipase(HTGL)の作用を受けてコレステロールに富むLDLとなる.このようにして形成されたLDLはLDL受容体を介して各種細胞に取り込まれ,そのコレステロールが利用される.副腎ではステロイドホルモン,性腺では性ホルモン,肝臓では胆汁酸の合成に利用される.また,細胞膜の一部としても利用される.このように,肝臓由来リポ蛋白は,肝臓で合成された脂質を,各種末梢細胞へ必要な脂質を分配するという役割を演じている.
c.HDLによるコレステロール逆転送系
HDLは動脈硬化の「負」の危険因子として,疫学的に認められてきた.その分子機構もわかってきた.HDLの主要アポ蛋白はアポA-Ⅰであるが,アポA-Ⅰはきわめて脂質親和性の強い,両親媒性蛋白である.したがって,細胞表面の脂質すなわちコレステロールとリン脂質を界面活性作用により取り込むと考えられてきた.この作用もあるが,最近,図13-4-9に示したように細胞表面にATP binding cassette A1(ABCA1)が存在し,これが細胞からコレステロールをアポA-Ⅰに受け渡す運搬体であることがわかってきた(Tallら,2008).したがって,細胞内コレステロールは,アポA-Ⅰの存在とABCA1により調節されていると考えられる.HDLの欠損病であるTangier病はABCA1の分子異常が病因であることが明らかになっている. 細胞からコレステロールとリン脂質を受け取ったアポA-Ⅰは,いわゆる原始型HDLとよばれ,図13-4-10に示したように形態も円板状を呈している.血中では肝臓で合成されるlecithin:cholesterol acyltransferase(LCAT)の作用でコレステロールからCEが形成され,レシチンはリゾレシチンになる.形成されたCEは,疎水性が強く円板状の原始型HDLの内部に移行し,徐々にHDLは球形になり,成熟化してHDL3となる.CEの形成とともにHDL3のサイズは増し,さらに成熟化しHDL2となる.このCEに富むHDL2からはCE transfer protein(CETP)の作用でCEがVLDLやLDLへ運搬される.この経路により,最終的に生体のLDL受容体を約80%有する肝臓にCEが運ばれる.このように末梢細胞からHDLを介してコレステロールが肝臓に戻される経路をコレステロール逆転送系とよんでいる.肝臓にはさらにscavenger receptor type B-Ⅰ(SR-BⅠ)という受容体がある.SR-BⅠはHDL中のCEを特異的に取り込み,肝臓から胆汁中へ排泄されるコレステロールのプールを形成している.また,HDL受容体も存在し,HDL自体の取り込みもあるという.さまざまな形で,HDLのコレステロールは肝臓に取り込まれるが,これは生体がコレステロールをきわめて重要な脂質として大事に利用していることの現れと考えられている.[寺本民生]
■文献
Altmann SW, Davis HR Jr, et al: Niemann-Pick C1 like 1 protein is critical for intestinal cholesterol absorption. Science, 303: 1201-1204, 2004.
Brown MS, Goldstein JL: Familial hypercholesterolemia: A genetic defect in the low-density lipoprotein receptor. N Engl J Med, 294: 1386-1390, 1976.
Tall AR, Yvan-Charvet L, et al: HDL, ABC transporters, and cholesterol efflux: implications for the treatment of atherosclerosis. Cell Metab, 7: 365-375, 2008.
出典 内科学 第10版内科学 第10版について 情報