化学辞典 第2版 「律速段階」の解説
律速段階
リッソクダンカイ
rate-determining step
一般に,化学反応はいくつかの素反応過程から構成される複合反応であるが,全体としての反応の速度にもっとも大きく影響する素反応過程を律速段階という.反応の形式によって律速段階は異なり,並発反応(図)では,与えられた条件のもとでもっとも速度の大きい素反応過程が原系物質の減少を支配する過程となる.一方,連続反応
A→ I1→ I2→…→P
では,逆にもっとも速度の小さい過程が全体としての速度を支配する.したがって,温度の変化につれて律速段階が一つの過程からほかの過程に移るときは,速度の対数ln vと絶対温度の逆数1/Tとの関係を与える線は屈曲を生じ,前者では上方に凹,後者では凸となる.連続反応で律速段階より前の中間状態は反応の原系とほぼ平衡になっており,後の状態は生成系との平衡に近い.これらの関係を部分平衡または予備平衡という.したがって,全反応についての自由エネルギー差は律速素反応の自由エネルギー差にほぼ等しい.律速段階を決めるには,全反応の経路を定め,そのなかの任意の素過程を律速段階と仮定して求めた速度式と実測による結果との比較を行うか,化学量数の測定による.理論的に各素反応の速度定数を算出して比較することも可能となりつつある.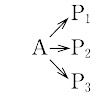
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「律速段階」の意味・わかりやすい解説
律速段階
りっそくだんかい
rate limiting step
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
日本大百科全書(ニッポニカ) 「律速段階」の意味・わかりやすい解説
律速段階
りっそくだんかい
rate-determining step
化学反応において一つの全反応を構成する素反応(それ以上分けられない個々の反応)のなかで、もっとも速度が遅く、それによって全反応の速度が決められてしまう素反応をいう。律速反応または律速素反応ともいう。一つの化学反応式で表される反応は、通常いくつかの素反応から成り立っている。素反応のおこる速度(正しくは速度定数)は、それぞれ異なっているから、もしそのなかに他のものに比べてずっと速度が小さい素反応があれば、全体の反応の速度はこの素反応の速度で律せられる。その他の反応は通常これに比べてずっと速く、ほぼ平衡にあると取り扱うことができるから、反応進行時の原系と生成系との自由エネルギーの落差は、すべてこの律速段階の原系と生成系の間にかかることになる。
[戸田源治郎・中原勝儼]
栄養・生化学辞典 「律速段階」の解説
律速段階
世界大百科事典(旧版)内の律速段階の言及
【有機化学反応】より
…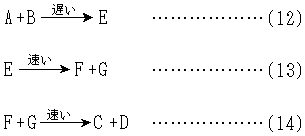 式(12)~(14)を反応(11)の反応機構という。反応の各段階は一般に異なる速度で進行するが,上の例では第1段階(式(12))の反応速度が遅く,全反応速度はこの段階によって規定されるので,反応の律速段階rate determining stepという。反応の経過に際して生じるE,F,Gが実際に単離可能である場合,これらは反応中間体という。…
式(12)~(14)を反応(11)の反応機構という。反応の各段階は一般に異なる速度で進行するが,上の例では第1段階(式(12))の反応速度が遅く,全反応速度はこの段階によって規定されるので,反応の律速段階rate determining stepという。反応の経過に際して生じるE,F,Gが実際に単離可能である場合,これらは反応中間体という。…
※「律速段階」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

