翻訳|battery
精選版 日本国語大辞典 「電池」の意味・読み・例文・類語
でん‐ち【電池】
- 〘 名詞 〙 物質の化学反応または物理反応によって放出されるエネルギーを、直接電気エネルギーとして取り出す装置。一般に負極および正極の間にイオン導電体をおき、酸化・還元反応を行なわせ、このときのエネルギーを電気エネルギーとして取り出す化学反応電池と、物質に外部から光・放射線・熱などの物理的エネルギーを与え、これを電気エネルギーに変換させる物理反応電池に大別される。化学反応電池には一次電池・二次電池(バッテリー)・燃料電池などが、物理反応電池には太陽電池・原子力電池・熱電池・光電池などがある。一般には化学反応電池をさす。
- [初出の実例]「『グロウブ』の電池を準備する方」(出典:小学化学書(1874)〈文部省〉附録)
電池の語誌
アメリカの物理学書の漢訳である「格物入門」が日本でも「格物入門・訓点」(一八七〇)、「格物入門和解」(一八七一)として発刊され、そこに「電池」が使われていたことでこの語が定着した。それ以前は、「バッテリ(抜的麗)」「ガルハニ(瓦爾華尼機)」などがあった。
日本大百科全書(ニッポニカ) 「電池」の意味・わかりやすい解説
電池
でんち
battery
galvanic cell
voltaic cell
物質系の変化によって放出されるエネルギーを直接電気エネルギーに変換する発電装置と定義できる。系の化学変化に伴うギブス自由エネルギー変化(物質が定温定圧下で化学反応をすると内部エネルギーが変化するが、その変化のうち仕事に変わりうる部分)を利用するものを化学電池といい、物理的変化を利用するものを物理電池、そして生物的あるいは生物化学的変化を利用するものを生物電池(生物化学電池)という。一般には化学電池を単に電池とよぶことが多い。また物理電池と生物電池などを一括して特殊電池とよぶことがある。
今日の化学電池の原形は1800年にボルタが亜鉛板と銅板を希硫酸に浸漬(しんし)し、電力を取り出すことに成功したボルタ電池であるといわれる。
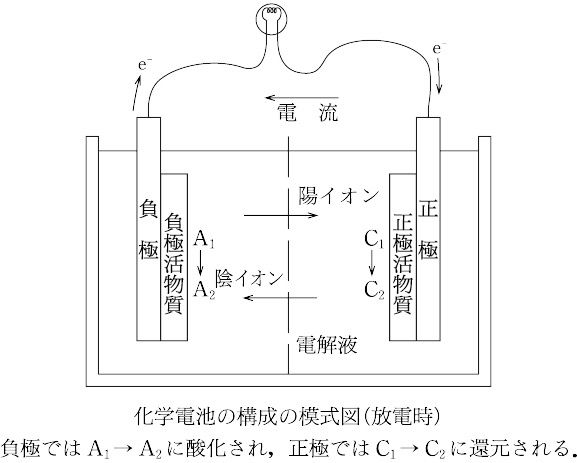
化学電池は基本的には二つの電極と電解質および隔膜から成り立っている。電池を放電すると酸化反応が進行して生じた電子が外部回路側へ流出する電極を負極、また外部回路から電子が流入し還元反応が進む電極を正極とよんでいる。そして負極と正極での起電反応に関与する化学物質をそれぞれ負極活物質および正極活物質という。
化学電池を表示する場合、放電時に酸化反応がおこる負極を左側に、還元反応がおこる正極を右側に書く。したがって、負極活物質の還元体と正極活物質の酸化体をそれぞれN(Red)およびP(Ox)とすると
N(Red)|電解質|P(Ox)
で表示できる。そして電極反応は
(負極)
N(Red)―→N(Ox)+ne-
(正極)
P(Ox)+ne-―→P(Red)
と示すことができ、電池反応は両電極反応の和
N(Red)+P(Ox)―→N(Ox)+P(Red)
によって与えられる。
化学電池の起電力(開放電圧)は上記の電池反応のギブス自由エネルギー変化を用い、ネルンストの式から求めることができる。しかし実際には不可逆的な現象を伴うため、ギブス自由エネルギー変化の一部は熱エネルギーなどの形で消費され、オーム抵抗などもあるので、放電中の電池電圧は起電力よりつねに小さくなる。この電池電圧により外部回路に流れる放電電流を用いて電気的な仕事をさせるものが電池である。
化学電池はその特性に応じて一次電池、蓄電池(二次電池)および燃料電池の3種類に分けることができる。一次電池は不可逆的化学反応を利用し、1回の放電しか利用できないものをいい、化学反応が可逆的で外部電源により電流を逆に流して充電すれば繰り返し使用できるものを蓄電池という。そして燃料電池は、閉じた系内で電池反応を行う一次電池や蓄電池と異なり、燃料(水素、一酸化炭素、炭化水素、メタノールなど)と酸素(空気)を外部から連続的に供給し、燃料の電気化学的酸化反応によって生じる化学エネルギーを直接電気エネルギーとして取り出す電池をさす。このとき反応生成物は連続的に系外へ除去される。
化学電池は宇宙開発や海洋開発に必要な電源として、また小形可搬形電子機器の電源として重要な地位を確立している。そして電気自動車やハイブリッド・カー用をはじめ、電力負荷平準化用の電源、さらにオンサイト形発電装置として利用されるまでになったが、性能と安全性、信頼性のさらなる向上を目ざして研究開発が精力的に進められている。
物理電池は外部から光や熱、放射線などのエネルギーを照射して、電池を構成する物質系のエネルギーを高い状態としたのち、物理的、化学的変化によりエネルギーの低い安定な状態に戻るときに放出するエネルギーを直接電気エネルギーに変換するものである。これらには太陽電池をはじめ、光化学電池(光電池)、熱電池、原子力電池などがある。
生物電池は酵素や微生物のような生物の機能を利用したものである。生物による化学反応を利用しているので、広義には化学電池の一種とみなすことができよう。
[浅野 満]
『橋本尚著『電池の科学――生物電池から太陽電池まで』(1987・講談社)』▽『高村勉・佐藤祐一著『ユーザーのための電池読本』(1988・コロナ社)』▽『竹原善一郎著『電池――その化学と材料』(1988・大日本図書)』▽『池田宏之助著『電池の進化とエレクトロニクス――薄く・小さく・高性能』(1992・工業調査会)』▽『池田宏之助編著、武島源二・梅尾良之著『「図解」電池のはなし』(1996・日本実業出版社)』▽『岡田和夫著『電池のサイエンス――くらしをささえる名脇役』(1997・森北出版)』▽『小久見善八編著『電気化学』(2000・オーム社)』▽『電気化学会編『電気化学便覧』(2000・丸善)』▽『電池便覧編集委員会編『電池便覧』(2001・丸善)』
ブリタニカ国際大百科事典 小項目事典 「電池」の意味・わかりやすい解説
電池
でんち
battery
ボルタ電池は最も単純な構造の電池で,電極として銅と亜鉛の薄片または棒を,電解液として希硫酸を使用する。銅が陽極,亜鉛が陰極となる。両極の一部を電解液に浸し,電解液の外に出た部分を導線でつなぐと,電流が発生する。ボルタ電池は銅の電極に水素の泡が集まって電子の流れを止めてしまうため,寿命が短かった。 1836年,イギリスの化学者ジョン・F.ダニエルが,この分極と呼ばれる現象を起こさないダニエル電池を発明した。さらに 1866年頃,フランスの化学者ジョルジュ・ルクランシェが分極を起こさないマンガン乾電池を考案した。ルクランシェは,陽極に炭素を,陰極に亜鉛を用い,塩化アンモニウムを電解液とした。この組み合わせでも水素は放出されるが,電池内の炭素と二酸化マンガンの混合物に吸収される。今日の乾電池も同じ素材で構成されている。塩化アンモニウムの電解液はゼリー状で多孔性物質にしみこませてあり,コップ状に形成された亜鉛が容器となっている。電解液が漏れないよう,上部は密封されている。電池全体が鉄製の容器で覆われていることが多い。
二次電池として今日最も一般的に使われているのは,自動車に用いられる鉛蓄電池で,1859年にガストン・プランテが開発した。同じく充電が可能なニッケル-カドミウム電池は 1917年にパリの地下鉄の車内照明として初めて本格的に使用された。
燃料電池は,化学反応によって生じたエネルギーを直接,電気エネルギーに転換するものである。その原理は 1839年,イギリスの物理学者ウィリアム・グローブによって発見された。長らく実用化されなかったが,低公害自動車の動力として開発が進められている。原子力電池は,ストロンチウム 90などの放射性物質から出る放射線を集電装置に取り込む仕組みで,この集電装置が陰極,放射性物質が陽極となる。原子力電池は,高電圧,低電流の電気を生み出すことができる。太陽電池は,太陽光を直接,弱い電流に転換するものである。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
改訂新版 世界大百科事典 「電池」の意味・わかりやすい解説
電池 (でんち)
cell
光,熱,化学エネルギーなどを電気エネルギーに変換する装置。化学電池と物理電池に大別される。化学電池は電気化学反応を利用して化学エネルギーを電気エネルギーに変換する装置で,単に電池といった場合は通常化学電池を指す。ほとんどの化学電池では,装置に用いられる化学物質に必要なときだけ化学反応を起こさせて電気エネルギーを取り出すことができるので,電気エネルギーの貯蔵装置にもなる。これに対し,物理現象を利用して他の形態のエネルギーを電気エネルギーに変換する装置が物理電池で,太陽光エネルギーを電気エネルギーに変換する装置は太陽電池と呼ばれ,放射線のエネルギーを電気エネルギーに変換するのが原子力電池である。熱電池には,ゼーベック効果を利用して熱エネルギーを電気エネルギーに変換する熱電対形電池と真空中の熱陰極から熱電子が放出される現象を利用した熱電子形電池がある。
化学電池は一次電池,二次電池,燃料電池に大別されるが,化学エネルギーを電気エネルギーに変換する仕組みは同じである。すなわち,酸化剤を陽極活物質,還元剤を陰極活物質として,電解液の中に対置させ,両極を連結すると,陽極では電子受容反応(還元反応),陰極では電子放出反応(酸化反応)が起こり,外部負荷を通って電子は陰極より陽極に移動し,電流が陽極から陰極に流れる。また電解液中ではイオンが移動して電流を運ぶ。
化学電池の酸化剤,還元剤を活物質というが,一次電池は,放電によって活物質が消費され,それ以上放電ができなくなったときに廃棄してしまう形式の電池で,実用一次電池としては,マンガン乾電池,アルカリマンガン乾電池,酸化銀電池,水銀電池,ニッケル-亜鉛電池,空気電池,リチウム電池などがある。リチウム電池以外の諸電池では電解液は水溶液で,リチウム電池では非水溶媒に電解質を溶解したものが用いられる。表1に実用一次電池をまとめて示す。
放電によって活物質が消費し尽くされてしまったとき,外部から電力を供給して活物質を再生(充電という)して,繰り返し使う形式の電池が二次電池で,蓄電池ともいう。主要な実用二次電池を表2に示す。このうちニッケル-カドミウム電池はアルカリ蓄電池の一種で,電極の製造法によりユングナー電池と焼結式電池に大別される。
燃料電池は,陽極活物質に酸素,陰極活物質に燃料を用いる形式の電池で,燃料と酸素を連続的に供給し,燃焼生成物を連続的に系外に取り出しながら発電を行うところに特徴がある。現在は水素燃料電池が最も開発が進んでいるが,そのほかヒドラジン,メタノールなどを燃料とする電池もある。
執筆者:笛木 和雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「電池」の意味・わかりやすい解説
電池【でんち】
→関連項目可逆電池|濃淡電池|能動素子
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「電池」の解説
電池
デンチ
cell
正極と負極に生じる電位差によって電気エネルギーを取り出すための装置.化学変化に伴う自由エネルギーの減少分を直接電気エネルギーとして外に取り出すマンガン電池や鉛蓄電池のような化学電池と,光エネルギー,熱エネルギー,放射線などの注入により系をエネルギーの高い不安定な状態に励起し,ついでエネルギーの低い安定な状態へ戻るときの自由エネルギーの減少分を電気エネルギーとして取り出す太陽電池,熱電池,原子力電池などの物理電池に大別できる.また,化学電池は1回の放電のみ可能な一次電池と,繰り返し充・放電可能な二次電池(蓄電池)とに大別できる.前者としては,マンガン乾電池,アルカリマンガン乾電池,空気電池などが実用化され,後者としては,鉛蓄電池,ニッケル-カドミウム電池,ニッケル-水素電池,リチウムイオン電池などが実用化されている.燃料電池は反応物および生成物を通過させて使用する発電機の性格を有するため,一次電池および二次電池には含まない.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
関連語をあわせて調べる
[名](スル)二つ以上のものが並び立つこと。「立候補者が―する」「―政権」[類語]両立・併存・同居・共存・並立・鼎立ていりつ...