化学辞典 第2版 「反応等温式」の解説
反応等温式
ハンノウトウオンシキ
reaction isotherm
一つの化学反応で,一定温度において,任意の分圧の反応物質から任意の分圧の生成物質が生じるときのギブズエネルギー変化を各物質の分圧と関係づける式.反応,
aA + bB + … = l L + mM + …
において,左辺の反応物質の分圧を pA,pB,…,右辺の生成物質の分圧を pL,pM,…とするとき,この反応に伴うギブズエネルギーの変化ΔGは,
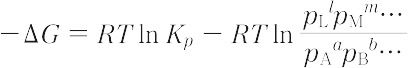
で与えられる.ここで,Kp は分圧で表した平衡定数,Rは気体定数,Tは絶対温度である.この式を導くにあたっては理想気体を仮定している.各物質の分圧のかわりに濃度を用いても同じ型の関係式が得られる.理想気体以外の気体,溶液についても,分圧のかわりに各物質の活量を用いれば同じ型の式が成り立つ.平衡状態では,右辺第二項は平衡定数にほかならないから,この場合はΔG = 0.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

