化学辞典 第2版 「速度定数」の解説
速度定数
ソクドテイスウ
rate constant
反応速度定数ともいう.化学反応
aA + bB + …→mM + nN + …
において,反応物質A,B,…,生成物質M,N,…,および反応系に共存して反応速度に影響を与える物質X,Y,…の濃度または分圧の関数f(cA,cB,…,cM,cN,…,cX,cY,…)を用いて,反応速度を
v = kf(cA,cB,…,cM,cN,… cX,cY,…)
と表すとき,その式を反応速度式といい,反応速度vと,濃度関数の間の比例定数kを速度定数という.したがって,速度定数は反応の種類とアレニウス式で示されるように温度のみに依存する定数である.速度が質量作用の法則に従うような素反応では,
v = k[A]a [B]b …
があらゆる濃度範囲で成立し,速度定数の物理的意味も遷移状態理論によって明らかにされる.しかし,多くの素反応よりなる複合反応では,反応速度式は各成分の濃度の複雑な関数となることが多い.H2 と Br2 から臭化水素を生成する気相反応では,
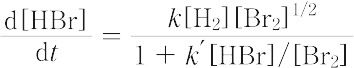
となり,速度定数kは,この反応を構成する素反応,
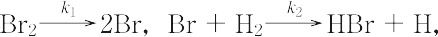
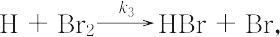
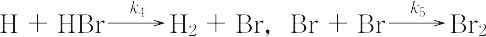
の速度定数 k1~k5 の関数になり,
k = 2k2(k1/k5)1/2,
定数k′は
k′ = k4/k3
となる.また,複合反応では,一般に反応系の濃度域によって速度式がかわることがあり,速度式がかわれば速度定数も当然変化する.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

