化学辞典 第2版 「遷移状態理論」の解説
遷移状態理論
センイジョウタイリロン
theory of transition state
活性錯体理論ともいう.化学反応の遷移状態にあたる活性錯体の概念にもとづき,絶対反応速度論の一形式としてH. Eyring(アイリング)によってその大略が完成された理論である.ある定容下の化学反応,
A + B  X
X → 生成系
→ 生成系
を考える.X は原系と生成系のごく近傍に存在する反応系で活性錯体とよばれる.活性錯体は並進,回転および反応座標軸方向の振動を除く振動の自由度をもつ一種の準安定分子で,反応系のポテンシャルエネルギー(正確には自由エネルギー)を反応系の全構成原子の位置の関数として表したエネルギー曲面上を,反応系の代表点が原系から生成系に向かってなるべくエネルギーの低い点をたどって進むときに超えるエネルギー最高の位置,すなわちエネルギー曲面上ではいわゆる鞍点の部分に存在する反応系にあたる.原系と活性錯体間に K
は原系と生成系のごく近傍に存在する反応系で活性錯体とよばれる.活性錯体は並進,回転および反応座標軸方向の振動を除く振動の自由度をもつ一種の準安定分子で,反応系のポテンシャルエネルギー(正確には自由エネルギー)を反応系の全構成原子の位置の関数として表したエネルギー曲面上を,反応系の代表点が原系から生成系に向かってなるべくエネルギーの低い点をたどって進むときに超えるエネルギー最高の位置,すなわちエネルギー曲面上ではいわゆる鞍点の部分に存在する反応系にあたる.原系と活性錯体間に K を濃度平衡定数として,熱的平衡,
を濃度平衡定数として,熱的平衡,
[X ] = KC
] = KC [A][B]
[A][B]
を考え,X の生成系へ向かっての分解速度,
の生成系へ向かっての分解速度,
v = k [X
[X ] = k
] = k KC
KC [A][B]
[A][B]
をもって反応速度の絶対値とする.k は X
は X の分解速度定数であり,k
の分解速度定数であり,k KC
KC は統計力学的に,
は統計力学的に,
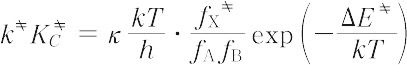
で与えられる.ここで,kはボルツマン定数,hはプランク定数,Tは絶対温度,fX ,fA,fB はそれぞれ X
,fA,fB はそれぞれ X (反応座標軸方向の振動の自由度を除く),A,Bの分配関数,Δ E
(反応座標軸方向の振動の自由度を除く),A,Bの分配関数,Δ E は活性化エネルギーで活性錯体と原系の間の内部エネルギー差を表す.κは透過係数といわれ,エネルギー曲面の形にもとづく計算の補正係数で1に近い.実際の反応速度にこの式を適用する場合には熱力学的表現がよく使われ,定容反応ではΔ F
は活性化エネルギーで活性錯体と原系の間の内部エネルギー差を表す.κは透過係数といわれ,エネルギー曲面の形にもとづく計算の補正係数で1に近い.実際の反応速度にこの式を適用する場合には熱力学的表現がよく使われ,定容反応ではΔ F を活性化ヘルムホルツエネルギー,Δ S
を活性化ヘルムホルツエネルギー,Δ S を活性化エントロピー,Rを気体定数として,
を活性化エントロピー,Rを気体定数として,
-RT ln KC = Δ F
= Δ F = Δ E
= Δ E - TΔ S
- TΔ S
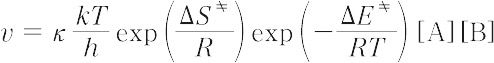
定圧反応では,Δ H を活性化エンタルピー,Δ G
を活性化エンタルピー,Δ G を活性化ギブズエネルギーとして,
を活性化ギブズエネルギーとして,
-RT ln Kp = Δ G
= Δ G = Δ H
= Δ H - TΔ S
- TΔ S
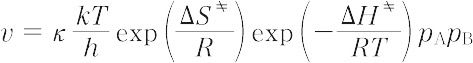
と表される.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

