法則の辞典 「クリスチアンセンの式」の解説
クリスチアンセンの式【Christiansen equation】
A+B+D+F+…+L
→ C+E+G+…+M+N
この式で表される反応が,実は下のように不安定な中間体 X1,X2,…,Xn-1 との反応を含む素反応の組合せとして進行すると考える.ここで,k1,k2,…,kn は正反応の速度定数,k-1,k-2,…,k-n は逆反応の速度定数である.
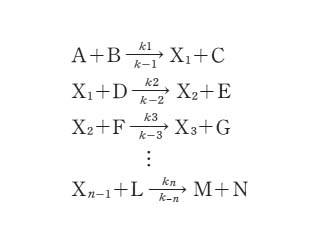
中間体は十分速やかに反応して,蓄積されることがないと考えると,反応は定常的に進行して,この速度は
v=v+-v-
となる.ここで v+,v- はそれぞれ次のような式で与えられる量である.
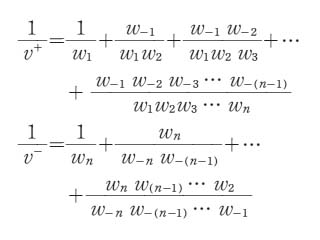
ここに w は反応の確率を表す量でA,B,C,…の濃度を[A], [B], [C],…で表したとき
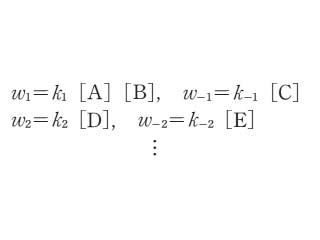
で表される量である.

