化学辞典 第2版 「ペルオキソクロム酸塩」の解説
ペルオキソクロム酸塩
ペルオキソクロムサンエン
peroxochromate
高酸化数のCrのペルオキソ錯体には,たとえば,CrⅤのMⅠ3[CrⅤ (O2)4],CrⅥのMⅠ2[CrⅥ2O2(O2)5],MⅠ[CrⅥO(O2)2OH](M = K,NH4,TIなど),CrのN配位子を含む比較的安定な混合錯体などがある.【Ⅰ】MⅠ3[CrⅤ (O2)4](M = K,Na,NH4など):正式名テトラキス(ペルオキソ)クロム(Ⅴ)酸塩[CAS 12526-97-5].K3CrO8(297.27);CrⅥ O8の濃水溶液に過剰のKOHを加え,氷冷して,H2O2を加えると得られる.同様な手法で,Na,NH4塩なども得られる.K塩は,赤~赤褐色の正方晶系柱状晶.[CrO8]3- は,Cr原子のまわりに4個の O22- が正四面体型に位置して,それぞれがキレート二座配位し,計8個のO原子は正十二面体型に配置している.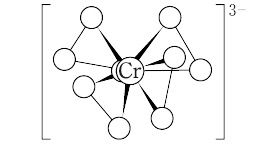 Cr-O約1.87,1.97 Å,O-O約1.47 Å.∠O-Cr-O約46°(キレート環),90~95°(異 O2 間),∠Cr-O-O約71,64°.常磁性で,不対電子1個をもつ.室温では安定だが,加熱すると分解し,さらに高温では爆発することもある.冷水には難溶.水溶液に酸を加えると CrⅥ錯体にかわって青変し,これはエーテルで抽出可能である.
Cr-O約1.87,1.97 Å,O-O約1.47 Å.∠O-Cr-O約46°(キレート環),90~95°(異 O2 間),∠Cr-O-O約71,64°.常磁性で,不対電子1個をもつ.室温では安定だが,加熱すると分解し,さらに高温では爆発することもある.冷水には難溶.水溶液に酸を加えると CrⅥ錯体にかわって青変し,これはエーテルで抽出可能である.
[CrⅤ(O2)4]3- + 2H+ + H2O →
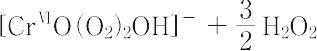
【Ⅱ】MⅠ2[CrⅥ2O2(O2)5](M = K,NH4など):正式名は,ジオキソペンタキス(ペルオキソ)二クロム(Ⅵ)酸塩[CAS 12331-76-9].MⅠ[CrⅥO(O2)2OH]と書くこともある.二クロム酸塩(K,NH4塩など)の弱酸性塩酸水溶液にH2O2を加えるか,エーテル中でCrO3とH2O2とをまぜ,これにKOH(またはNH3など)のエタノール溶液を加えて反応させると生成する.固体には,-O-O-または-OOHが含まれると思われるが,構造は明らかでない.反磁性の暗紫青色の不安定な固体.加熱,衝撃,濃硫酸添加などで爆発する.水に可溶.水溶液は紫色を呈する.酸性水溶液からこの着色物をエーテルで抽出できる.室温の空気中では固体は徐々に分解して二クロム酸塩にかわる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
