化学辞典 第2版 「衝突説」の解説
衝突説
ショウトツセツ
collision theory
化学反応を進行させる推進力を分子間の衝突に求め,反応速度を反応分子間の衝突数にもとづいて考えようとする説.この説によれば,反応に関与する分子AおよびBが衝突する際,分子どうしが適当な配置をとり,かつ衝突に際して両分子の相対運動のエネルギーが反応に必要なある量Eを超えていれば反応が進むと仮定する.気体分子運動論より,衝突回数 ZAB は,
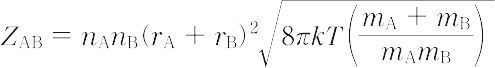
となる.エネルギーがE以上になる衝突の確率は
exp{-E/(kT)}
で表される.ここで,nは分子の濃度,r = rA + rB は衝突半径,mは分子の質量,kはボルツマン定数,Tは絶対温度である.したがって,反応速度vはpを立体因子として,
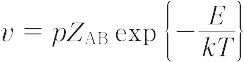
で示される.ここで,Eはアレニウス式の活性化エネルギーEa に対応する.この説はいくつかの反応で実測値とよい一致を示し,1920年代には反応速度理論(化学反応速度論)の主流となったが,p ≫ 1の反応の出現によりその説明が困難となり,また活性化エネルギーの説明が経験的で明確さを欠くため,その後出現した遷移状態理論にその位置を奪われた.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

