デジタル大辞泉 「分子」の意味・読み・例文・類語
ぶん‐し【分子】
2 団体を構成している各個人。集団の構成員。成員。「不平
3 ある性質や様相を形成している一部分。
「変化は則ち文学以外の―なり」〈子規・芭蕉雑談〉
4 分数または分数式で、割られるほうの数や整式。⇔分母。
[類語]粒子・原子・原子核・原子団・アトム・イオン・素粒子・電子・陰電子・陽電子・陽子・中間子・中性子・光子・エレクトロン・プロトン・ニュートロン・ニュートリノ
翻訳|molecule
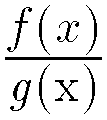 における a や f(x) のこと。⇔分母。
における a や f(x) のこと。⇔分母。分子は物質としての機能をもった最小の構成単位で,一般には安定である。分子は原子が化学結合してつくられ,その種類は600万以上に及び,毎年,数十万種の分子が新しく合成されたり,単離されている。英語のmoleculeはラテン語の〈量〉とか〈塊〉を意味するmolesと縮小辞のculaとを結びつけて物質固有の特性をもつ最小単位粒子を意味し,分子概念の本質をよく示している。
錬金術時代を経たヨーロッパにおいては,哲学的で空想的な物質構成単位としての元素の概念が時代とともに科学的な言語となりつつあった。そして18世紀に入り実験に基づいて元素を構成する原子の存在に置き換えられていった。J.ドルトンは,空気は窒素,酸素,二酸化炭素などの混合物であるとの考え方から,原子説を提出した。その内容は現在と変わらず〈元素は原子から成り立っている。原子は決まった重さ(質量)をもち,化合物は異なった種類の元素の原子が結合してできたものである〉として,元素記号を提案するとともに,それを用いて化合物を表示した(図1)。
19世紀初頭の1808-09年,J.L.ゲイ・リュサックは気体反応の法則を発表した。それは,同じ温度,同じ圧力で同量の気体どうしを反応させると,〈最初に用いた気体の体積と,反応して生成した気体の体積とは簡単な整数比をもつ〉とする法則である。この法則の根底には,同じ温度・圧力条件下では,同一体積中に同数の粒子が含まれているとする考え方があった。それを明確に打ち出したのが〈アボガドロの法則〉である。A.アボガドロは,気体を構成している粒子は原子1個1個ではなく,それが何個か結合してできた〈分子〉であるとして,分子の概念を提出した。そして〈同じ温度,同じ圧力のもとでは,決まった体積の中には同じ数の分子が含まれている〉としたのである。これによって分子の考え方の登場をみた。そして当時まだ混同されていた分子と原子の概念を,明確にしたのはカニッツァーロの実験である。S.カニッツァーロは1859年,同一元素を含む多数の化合物の分子量を測定し,それから原子量を導いている。一例として炭素化合物について述べる。表1に示すように,炭素を含む7種類の化合物の分子量を測定し,その中に含まれる炭素の含有量を分析によって求めた。そして,分子量中の炭素の量を計算し,その最大公約数を炭素の原子量とした。これによって,原子量12の炭素原子が酸素原子や水素原子と結合することによって,分子が構成されるとし,〈原子〉と〈分子〉の概念がより明確になり,ドルトン時代の原子・分子の混同も解消したのである。
分子の大きさは,ふつうオングストローム(Å=10⁻8cm)を単位として測定するほど小さく,もちろん1個1個の分子を肉眼で見ることはできない。しかし,分子は激しく熱運動しているので,気体分子中にある粒子の挙動で間接的に分子の存在を知ることができる。水面上に分散した花粉の中の微粒子や空気中に浮遊しているタバコの煙を顕微鏡で観測すると,それらが盛んに運動しているようすがみられる。これをブラウン運動と呼んでいる。その起因は,水や空気の超微小の分子が,花粉の微粒子やタバコの煙の粒子に絶えず衝突して,それらを生き物のように運動させているためである。この運動は,超微粒子としての分子の挙動として理論的に解析した気体分子運動論で正しく解明でき,気体が超微粒子である分子から組み立てられていることが証明されたのである。
分子は集合して液体や固体を構成する。これら凝縮体については,X線などを用いる構造解析によって,それらが分子によって組み立てられていることがわかり,分子自身の大きさを測定することもできる。最近の科学機器の進歩は,分子を目で見ることを可能にしている。それは電子顕微鏡の進歩と測定技術の飛躍的発展の結果,分子の像を直接とらえることに成功したのである。たとえば有機顔料であるフタロシアニン分子の薄膜の電子顕微鏡写真は,炭素原子や窒素原子が結合して分子が構成されているようすを示している(図2)。
分子は,原子が化学結合(共有結合を主体とする)によって組み立てられている。たとえば,水は水素原子2個と酸素原子1個が結合してH-O-H(H2O)となって,HとOとの間で相互に電子を共有して安定な分子ができる。同じように,メタンCH4では,炭素原子1個が等価の4個の水素原子と結合して,正四面体構造をもつ安定なメタン分子ができる。これら水やメタンの分子構造の研究では,分子を構成する原子の間の距離やその結合角を正確に求める。さらにこれらの分子内においては,原子どうしの結合は熱によって振動したり,結合を軸にして回転したりしている。このような分子の静的ならびに動的な構造は,X線回折や電子線回折とともに,紫外線からマイクロ波に至る広範囲な分光学的手法を駆使して非常に正確に求められており,物質構成の基礎である分子の状態を解明している。
原子の結合体である分子は,原子間の共有結合を繰り返すことによって分子量の大きい分子をつくり出すことができる。たとえば,メタンCH4の4個のC-H結合の一つが,水素原子の代りに他の炭素原子と結合し,その炭素の残された三つの結合がそれぞれ水素原子と結合すると,エタンC2H6ができる(図3)。これと同様な結合を繰り返していくと,プロパン,ブタン,ペンタンと直鎖状の炭化水素分子が組み立てられる。さらに,何十回,何百回とこの結合は繰り返していくことができ,大きい分子量をもった分子ができる。それはポリエチレンと呼ばれ,代表的なプラスチックである。このように分子量が数千から数十万に及ぶ分子を高分子という。高分子は,低分子量の分子にはない特性をもつ。たとえば,繊維状にしたり,薄膜にしたりすることができ,さらに可塑性や粘弾性など特異的な力学的性質を示す。これが,高分子が広い用途をもって多方面に利用されている理由である。これら高分子には,炭素原子を主鎖とする分子のほかに,窒素原子や酸素原子,さらに硫黄原子等を含んだ高分子があり,デンプン,木材,タンパク質などは,これらが繰り返し結合した天然高分子である。
メタンCH4の4個の水素原子がすべて炭素原子と結合し,それが何百万個も何千万個も繰り返しつながった分子がダイヤモンドである。したがって,ダイヤモンドは1個の巨大な分子とみなすことができ,とくにこれらを巨大分子ということがある。グラファイトも同様に炭素原子からできた巨大分子である。高分子には,ケイ素原子と酸素原子を主体とする石英および粘土鉱物などの無機化合物の一群がある。半導体材料として不可欠のケイ素の結晶は,ケイ素原子がダイヤモンドと同じ構造を繰り返したものであって,ケイ素の結晶も巨大分子とみなすことができる。このケイ素原子の四つの結合が酸素原子と結合してできるSiO44⁻の正四面体中の二つの酸素が相互に共有されて組み立られた分子がSiO2の組成をもつ石英である。粘土鉱物は,SiO44⁻の正四面体イオンが鎖状,帯状,さらに層状に結合してできた複雑な構造をもつ高分子で,地殻を構成している。
一般に,分子は原子の外殻電子を相互に共有してできた安定な原子集団である。しかし,一,二の例外もある。原子はその原子番号だけの電子をもっている。外殻にある電子は,2個が対をつくって安定になろうとする性質をもつ。これが共有結合形成の基本である。ところが,原子のなかには,それがもっている電子をすべて対にして安定になっているものがある。それは希ガスと呼ばれる一群で,ヘリウムHe,ネオンNe,アルゴンAr,クリプトンKr,キセノンXeがそれである。これは原子1個で安定で反応性のきわめて低い気体として白熱電球の封入ガスなどに利用されている。これを単原子分子と呼んでいる。
他の例は,不安定分子の存在である。再度メタンを例として取り上げよう。メタンは,炭素原子のもつ4個の外殻電子を,4個の水素原子のおのおのが1個ずつもつ電子と対をつくって安定なCH4の構造をとる。メタン分子を放電管の中に入れて放電すると,4個の水素原子のうち,1個がとれて・CH3(メチル)の状態が出現する。これはきわめて反応性に富む。これを遊離基と呼び,さらに一般的に不安定分子という。このような不安定分子は,化学反応中でも存在していることが分光学的手段などによって確認されている。また宇宙空間のようにきわめて分子の存在濃度が希薄な状態で,かつ非常に低い温度(たとえば数Kから十数K)では,不安定分子どうしの衝突の可能性がきわめて低く,比較的長時間(1年くらい)存在しうる。事実,星間分子といわれるものには,不安定分子が分光学的手法によって確認されており,いかなる過程によって宇宙空間の中で複雑な分子が組み立てられていくかを知るのに,重要な情報を提供してくれている。
このように,原子が結合してできた安定な物質を分子として取り扱うと,金属や合金も金属原子が多数結合してできた巨大分子とみなすこともできる。また塩化ナトリウム(食塩)などのイオン結晶も,ナトリウム陽イオンNa⁺と塩素陰イオンCl⁻とが結合してNaClという分子的単位が多数積み重なって結晶が組み立てられていると考えうる。
物質の特性は,その構成単位である分子の性質による。色素が美しい色を示すのは,分子1個1個の中の原子の組立て方に起因している。ペニシリンやビタミン類の生理活性は,これらの分子と生体を構成する分子との相互作用による。さらに,分子が水酸基をもつと水にぬれやすい性質をもち,水に溶解する原因となる。分子中にフッ素原子を含むと,逆に水分子をはじくようになる。このように分子の構造が分子の性質を支配しており,分子の特性を知る物性化学が,分子構造の研究とともに分子科学の分野において重要な役割をもつことになるのである。
分子1個1個の性質とともに,分子が集合した分子固体の研究も,その実用面へのつながりが強く,急激に盛んになっている。鎖状に伸びた分子の集団が繊維として利用され,巨大分子のダイヤモンドが,その著しく強い結合によって,物質中最も硬い物質として研磨剤に利用されているのは,その代表例である。液晶は,それを構成している分子の型がその集合体の物性を支配している。液晶固体の中では,分子は規則正しく配列している。これらの配列が,加熱したときの熱運動の増加や,電場による分子の運動によって乱れる。それによって,液晶の反射能が異なり,反射面が明るくなったり,暗くなったりする。これを利用したのが液晶ディスプレーであり,分子固体として広く利用されている具体例である。これら分子固体の性質の解析も,物性化学の重要な研究対象である。
今まで分子量が大きいとか小さいという言葉をしばしば利用してきた。一方,分子は超微小の粒子で肉眼では見えない。それでいて,どうして分子量がわかるのだろうか。水分子1個の質量は2.98×10⁻23gで,とうてい直接測定することはできない。したがって,分子の質量について一つの基準を決め,それとの比較において分子量を決めている。
気体分子についての分子量の決め方について述べよう。いま,1気圧,0℃で1lの気体分子の質量を表2に示す。この中にはアボガドロの法則に従って,同数の分子が含まれているから,これらの質量の比が分子量の比となる。酸素分子O2(原子量O=16)の分子量を32として他の分子量を計算すると,水素は2.016,窒素は28.01などとなる。分子量はこのようにして決めた値で,無名数である。なお正確には炭素162Cの原子量を12.000として決めるべきである。しかし,この基準で酸素Oの原子量を決めると,15.9994±0.0001となり,O2=31.9988となって,普通の実験を行う範囲内ではO2=32とおいて問題は起こらないので,ここではO2を32として計算した。
分子量にグラム(g)の単位をつけて,酸素32g,水素2.016g,さらに窒素28.01gとするとき,その1気圧,0℃の状態に含まれる分子の数は同数で,その数は6.02×1023個である。これがアボガドロ数である。なお,現在の基準では162C12g中に含まれる炭素原子の数をアボガドロ数と定義している。アボガドロ数の分子を含む量を1molと呼んでいる。0℃,1気圧の分子1molが占める体積は22.4lである。これらの関係を用いて,気体分子や気化しやすい分子の未知の分子量Mを決めることができる。すなわち,
M=22.4×d
ここで,dは気体の密度で,分子量を知ろうとする気体の密度を測定すれば分子量を知ることができる。
気化できない分子の場合には,それが水などに溶けるならば,溶液の特性を利用して分子量を決めることができる。いま砂糖水を例にとってみよう。水の中に溶けた砂糖の分子は,水の中を動き回って容器の壁に衝突し圧力を及ぼす。この圧力が浸透圧である。この溶質の挙動は気体分子の運動と同じように考えて,アボガドロの法則を適用し,浸透圧から分子量を求めることができる。
古くから用いられている分子量の測定法に,溶液の沸点上昇と凝固点降下がある。水は0℃で凍るが,海水は0℃になっても凍結せず,また砂糖水も0℃では凍らない。これは,水に食塩や砂糖が溶けると,純水に比べて沸点が100℃より高くなり,凝固点(氷点)も0℃より低くなるからである。これを溶液の沸点上昇および凝固点(あるいは氷点)降下と呼び,その温度上昇または降下の度合(⊿T)は,一定温度,一定体積中に溶けている溶質粒子の数に支配される。したがって,分子量Mの溶質がωg溶けた溶液の温度変化を⊿Tとおくと,
M∝ω/⊿T
の関係が成り立ち,これからMを求めることができる。
最近の機器分析の進歩は,より直接的な分子量の測定方法を開発している。その一つは質量分析法である。1919年F.W.アストンによって,ネオンの同位体分離に成功した質量分析器は,その後の著しい進歩によって,分子量1000程度までの分子量の測定が行われており,さらに最近は5000程度の分子量の測定まで可能にしている。原理は,試料を気化して孤立した分子とし,それをイオン化する。このイオン分子を高真空中で流し,曲率をもった磁場の中に入れて,そのイオン分子流を曲げる。その曲率の度合は分子量によって異なる。したがって,このイオン分子流の曲率の大小から逆に分子量を決めることができる。分子量を決めるに当たって,質量分析法は簡便で有効な方法であるが,試料を気化する必要があり,利用範囲に制限が加えられる。
分子を元素記号で書くのに,水をH2O,酸素をO2,水素をH2と書く。このように,分子を元素記号で表示した式を分子式と呼んでいる。分子式の決め方は次のような方法による。水H2Oの化学分析の結果は,水素Hが11.19%,酸素Oが88.81%となる。これを元素の原子量で割ると,水分子を構成する水素と酸素の組成比が得られる。
水素(11.19÷1.008):酸素(88.81÷16)=2:1
から水を構成している水素と酸素の比は2:1となり,この比だけからはH2O,H4O2,H6O3,……と,いくつもの組合せが考えられる。したがって,分子式を決めるには,他の基準を導入する必要がある。それには水の分子量18を用いる。その結果,水はH2O(1×2+16×1=18)が分子式となる。
最近の進歩に,質量分析法とともに結晶構造解析の利用がある。本来分子式の決まった分子の,分子内の原子の配列および分子どうしの並び方を決めるこの結晶構造解析を用いて,高い分子量の化合物の分子式を正確に決め,さらにそれから分子量を決定することができる。
分子はその原子の結合のしかたによって,その分子に極性が生ずる。メタンCH4は対称性のよい構造をもち極性をもたない。しかし,メチルアルコールCH3OHでは分子内の原子の配列は一様でなく,分子自身強い極性をもつ。このような分子を極性分子と呼んでいる。水などの溶媒に対する溶解性やセッケンなどの分子の脱脂作用,さらにケイ素樹脂などの撥水効果などは,分子の極性の利用による。また電子レンジによる食料品や酒の加熱は,水やアルコールなどの極性分子が交流電場の作用によって激しく振動し,それが熱となって食品全体を加熱するためである。
以上のように,分子は物質の構成単位であり,分子とその集合体の研究は分子科学として,重要な研究分野を担っている。
執筆者:井口 洋夫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
原子が結合して生成した物質の基本構成単位。
1811年イタリアのアボガドロは、当時広く認められるようになったドルトンの原子説に対し、水素や酸素の単体が原子1個からなるのではなく、水素と酸素が反応して生じた水の分子も、水素原子1個と酸素原子1個からなるのではないことを主張し、水素、酸素はそれぞれ2個の原子が結合した分子をつくり、水の分子は水素原子2個と酸素原子1個が結合したものであるとの仮説を提出した。これが現代の分子像の最初の提案である。その仮説の正しいことは、1860年ドイツのカールスルーエで開かれた第1回万国原子量会議でアボガドロの後輩にあたるカニッツァーロの力説によって、ようやく化学者たちの支持を受けるようになった。そこで初めて原子量の正しい数値の算出が可能となり、この会議に出席していたロシアのメンデレーエフが、のちに元素の周期律を提出することになるのである。
同じころ、フランスのパスツールは酒石酸塩の光学異性体を分割し、オランダのファント・ホッフとフランスのル・ベルは有機化合物の光学異性体の構造と旋光能との関係を調べて、炭素が正四面体の中心から頂点の方向に結合の手を伸ばしている構造モデルを提案し、ドイツのケクレはベンゼン分子が正六角形に連結した炭素原子の環状構造をもつことを提案した。また、当時知られていた化合物のほとんどが簡単な整数比となる原子組成をもっていたため、すべての物質が単純な分子を基本単位としているとも考えられていた。
20世紀に入り、X線回折法をはじめとする分子構造の決定法が発達し、熱力学的な諸量における分子(モル概念)と実際の分子との対応もつけられるようになった。その結果、通常の純物質の分子は一定種類の原子がそれぞれ正確に勘定できる一定個数だけ集合し、一定の結合順序によって構成されたものであることが明らかとなった。アボガドロが考えた分子はこれに相当するので、この種の分子をアボガドロ分子ということがある。これに対し、イオン結晶や金属結晶では、イオン結合や金属結合が結晶全体に及んでおり、比較的少数の原子からなる独立した分子は存在せず、あえて分子というならば、結晶全体が一つの巨大な分子を構成していることになる。そこで、この種の分子を巨大分子ということがある。
一方、タンパク質やセルロースなどの高分子がきわめて分子量の大きな重合体であり、構成要素である単量体分子の単なる集合体ではないことが広く認められたのは1930年代のことであった。高分子は主として有機系、巨大分子は主として無機系の物質に使われる用語であるが、両者の間に本質的な差はない。
[岩本振武]
狭義の分子は複数の原子からなる電気的に中性な化学種であるが、分子運動や分子構造を論ずるときには原子やイオンを含むことも多い。気体分子運動論におけるもっとも簡単な分子は、分子回転や分子内での振動の寄与がない単原子分子である。現実には、希ガスの分子がこれに相当する。硫酸イオンのような多原子イオンや錯イオンの構造と分子構造との間には、電荷の有無を除けば本質的な差はない。たとえば、テトラヒドロホウ酸イオンBH4-、メタンCH4、アンモニウムイオンNH4+は、いずれも正四面体型の分子構造をもつ。電解質水溶液では、各イオンはそれぞれ独立した化学種として挙動し、電荷をもつ分子として扱うことができる。モル概念から誘導された物質(の)量は、物理・化学における基本単位の一つであり、単位名称はモル、単位記号molで示される。12C(質量数12の炭素原子)の0.012キログラムと同数の粒子を含む物質の量が1モルであるが、分子、イオン、原子、その他の基本的粒子のいずれであるかを問わず、アボガドロ定数個の集団が1モルとなる。1モル当りの熱力学的諸量の取扱いにおいても、分子、原子、イオンに対する区別はほとんどない。
[岩本振武]
もっとも簡単な構造をもつ分子は単原子分子であり、希ガス分子がその例となる。二原子分子は直線状であり、水素、窒素、酸素、塩素などその例は多い。三原子分子の二酸化炭素CO2は直線状であるが、水分子H2OはV字状である。アンモニアNH3は窒素原子を頂点とする三角錐(すい)の形となるが、リンの分子P4は各リン原子が頂点となる正四面体形である。アンモニア分子の三角錐も四面体形ではあるが、正四面体形ではない。BH4-,CH4,NH4+では、正四面体の中心にB、C、Nの各原子が位置し、各頂点にH原子が位置する。錯イオン[CoCl4]2-も正四面体形であるが、[Ni(CN)4]2-は正方平面形である。ヘキサシアノ鉄(Ⅲ)酸イオン[Fe(CN)6]3-も六フッ化硫黄(いおう)SF6もともに正八面体形である。ドデカボラン(12)酸イオンB12H122-は正二十面体の各頂点をB原子が占め、中心から頂点を結んだ線の延長上にH原子が位置する対称性の高い構造をもつ。
[岩本振武]
自然化学においては、なるべく精製された物質を用いて精密な実験を行い、その結果をなるべく単純化されたモデルによって理論的に説明する方法論が一般に採用されている。物理学、化学にとくにその傾向が著しい。しかし、天然に存在する物質系や人工的に合成される材料物質の多くはけっして単純な物質種ではなく、さまざまな化学種(分子、原子、イオンなど)が集合したものである。それらの理解は個々の分子に関する情報を正確に把握し、総合することによって可能となるとされており、分子集合体の物理・化学は今後の発展が期待される研究課題となっている。
[岩本振武]
『日本化学会編『分子集合体――その組織化と機能』(1983・学会出版センター)』
物質の化学的性質を備えた最小単位.種々の原子の結合によってできている.構成する原子の数に従って,単原子分子,二原子分子,三原子分子などという.原子数が数千,数万に及ぶときは高分子という.分子の概念はA. Avogadro(アボガドロ)によって1811年に提出された.その後,気体分子運動論が発展し,気体分子の大きさは,球とみなしたとき,直径が 10-8 cm 程度であろうと推定されていた.しかし,その実在が証拠づけられたのはA. Einstein(アインシュタイン)やJ.B. Perrin(ペラン)らのブラウン運動の研究によってである.現在では特殊な電子顕微鏡を使って拡大写真を撮り,視覚化することもできるようになった.分子を構成する原子間の結合距離,結合角など,いわゆる分子構造は各種の分光学的方法によって推定することができ,その結合様式は量子力学によって理論的に説明できるようになった.水素分子についてのハイトラー-ロンドンの理論はその先駆をなすものである.しかし,測定によって得られた結合エネルギーの値を量子力学で定量的に計算することは数学的に困難なため,ごく限られた分子について以外は成功していない.イオン結晶や金属結晶では,構成しているイオンや原子が同等な結合で無限につながっているので,これらの固体で分子という用語を使うのは不適当である.あえて名づけるとすれば,結晶全体を一つの巨大分子とよぶことができる.その点,分子性結晶では,分子間の相互作用が,分子内の原子間の結合をつくっている相互作用よりはるかに小さいので,気体分子と同じように,結晶中の分子を考えることができる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
出典 株式会社平凡社百科事典マイペディアについて 情報
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
… 原子内の電子が1個,あるいは2個以上放出されると正イオンになり,逆に中性原子に電子がとりこまれると負イオンになる。また,一般に2個以上の原子が結合すると分子になる。イオン,分子などの中の電子の状態は中性原子の中の電子の状態と同じではないが,原子の内側の部分にはあまり変化はなく,外側の部分が化学結合に関与する。…
※「分子」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...