化学辞典 第2版 「電池反応」の解説
電池反応
デンチハンノウ
cell reaction
ガルバニ電池を形成して電流を流したとき,電池内で進行すると考えられる全過程の反応の総和.例として,銀-塩化銀電極と水素電極とを組み合わせて構成される電池(Harned電池):

を考える.開回路で仮想的に,この電池を通して1ファラデーの正の電荷を左から右へ(Ⅰ→Ⅰ′)移動させると,Ⅰ相およびⅡ相のPt|Agの界面では,
Pt|Ag:e(Ⅱ) → e(Ⅰ)
の電子移動があり,また各電極系では,
銀-塩化銀電極:
Ag(Ⅱ) + Cl-(Ⅳ) → AgCl(Ⅲ) + e(Ⅱ) (2)
水素電極:

の電極反応が進行する.したがって,電池反応は以上のすべてを加え合わせて,
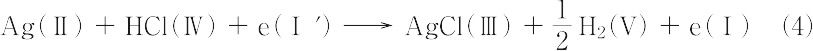
で与えられる.上式は開回路での電池反応とよばれる.次に,電池の両端子間を抵抗を通してつないで閉回路をつくり,正の電荷を電池内でⅠ→Ⅰ′の向きに移動させると,電池内では式(4)の電池反応が進行すると同時に,外部回路を通ってⅠ相の電子はⅠ′相へ移動する.
e(Ⅰ) → e(Ⅰ′) (5)
したがって,この場合の電池反応は,式(4)と式(5)を加え合わせて,次のように表される.

この式は見掛け上,普通の化学反応式と同じであり,閉回路の電池反応とよばれる.

のように,液-液界面(ZnSO4 ||CuSO4)を含む電池の場合には,正の電荷を電池内で左から右へ移動させると,各電極系における過程のほかに,液-液界面を通してのイオンの移動が起こる.したがって,このような電池を完全に表現するには,上記のイオン移動を考慮する必要がある.しかし,通常,液-液界面での現象を無視して,電池反応を,
Zn(Ⅱ) + Cu2+(Ⅳ) + 2e(Ⅰ′) → Zn2+(Ⅲ) + Cu(Ⅰ′) + 2e(Ⅰ)
Zn(Ⅱ) + Cu2+(Ⅳ) → Zn2+(Ⅲ) + Cu(Ⅰ′)
のように書くことが多い.
一般に,ガルバニ電池は二つの電極系を組み合わせて構成されるので,その電池反応は二つの電極系で起こる過程の和として与えられる.したがって,各電極系での過程,たとえば,上記のHarned電池の場合には,銀-塩化銀電極での過程(式(2))および水素電極での過程(式(3))は半電池反応とよばれる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

