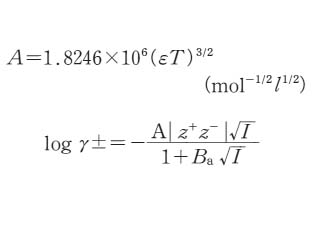最新 地学事典 「デバイ-ヒュッケルの式」の解説
デバイ-ヒュッケルのしき
デバイ-ヒュッケルの式
Debye-Hückel equation
希薄な電解質水溶液中のイオンの活動度係数を計算する式。符号および電荷の異なる溶存イオン間のエネルギー的相互作用を考慮に入れたDe-bye-Hückel理論から導かれた。イオン強度I(ただし,I<0.1mol/kɡ)の溶液中の電荷ziのイオンiの活量係数γiは次式で与えられる。
ただし,AおよびBは,それぞれ水の密度,誘電率および温度に依存するパラメーター,åiはイオンに固有の値で,長さの単位をもつことからイオンの有効半径と呼ばれる。より高いイオン強度の溶液に対しては,上式に biIの補正項(biはイオンに固有の値)を加えた拡張式が用いられる。
執筆者:日下部 実
出典 平凡社「最新 地学事典」最新 地学事典について 情報