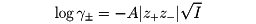イオン強度
いおんきょうど
ionic strength
水溶液の中に溶けている1種類のイオンまたは数種類のイオンの合計の示す働きの強さをいう。これは溶けているイオンの濃度と、イオンのもっている電荷の数に依存する。アメリカのG・N・ルイスとランドルMerle Randall(1888―1950)は、イオン強度Iを、
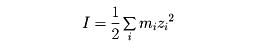
と定義した。ここでmは質量(重量)モル濃度(mol/kg溶媒)、zはイオンの電荷数、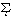 は全イオン種についての合計を示す。溶液中に溶けた、ある注目する電解質のイオンは、もし、その周りにイオン強度Iの多数の陰陽イオンの雰囲気が存在すると、それらから電気的相互作用を受ける。したがって、その挙動の自由さは制限される。その度合いは活動度係数γで表されるが、P・J・W・デバイ(オランダ生まれ。アメリカに帰化)とドイツのE・A・A・J・ヒュッケルは、Iとγの間の定量的関係
は全イオン種についての合計を示す。溶液中に溶けた、ある注目する電解質のイオンは、もし、その周りにイオン強度Iの多数の陰陽イオンの雰囲気が存在すると、それらから電気的相互作用を受ける。したがって、その挙動の自由さは制限される。その度合いは活動度係数γで表されるが、P・J・W・デバイ(オランダ生まれ。アメリカに帰化)とドイツのE・A・A・J・ヒュッケルは、Iとγの間の定量的関係
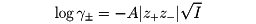
を導き、イオン強度さえ一定ならば、イオンの種類いかんによらず、注目する電解質の平均活動度係数は一定になることを示した。これをデバイ‐ヒュッケルの極限法則という。ここでγ±は、一つの電解質から生ずる陰陽両イオン(電荷の数はz-とz+)の平均の活動度係数(実験では平均しか測定できない)、Aは溶媒の性質によって決まる定数(25℃の水で0.509)である。この式は溶液が薄い場合、よく実験結果とあう。
[戸田源治郎]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
イオン強度
イオンキョウド
ionic strength
電解質溶液中のイオン間相互作用の強さを表す組成強度.溶液中のi種イオンの質量モル濃度を mi(mol kg-1 溶媒),イオン価を zi としたとき,
(1/2)Σ mizi2
と表される.G.N. Lewis(ルイス)およびM. Randallによって導入された.希薄電解質溶液の熱力学的性質を決める重要な量の一つである.与えられた1種類の強電解質を含む種々の希薄溶液において,それらの溶液のイオン強度が等しければ,その強電解質の平均活量係数は等しいという法則をイオン強度の法則という.電解質溶液に関する研究においては,この法則を用いて,一連の測定をイオン強度一定の条件下で行うことが多い.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
イオンきょうど
イオン強度
ionic strength
電解質溶液中の全イオン濃度を示す一般化された尺度。G. N.LewisとM.Randallによって導入された。陽イオン,陰イオンを問わず,溶液中のi番目のイオンの重量モル濃度をmi,その電荷をziとするとき,イオン強度Iは次式によって定義される。I=1/2(Σmizi2)。電解質溶液中のイオンの活量係数を求める際に使われるデバイ-ヒュッケルの式にはイオン強度が含まれる。希薄溶液中の任意の電解質の活量係数は,同一のイオン強度をもつ溶液中では一定である。
執筆者:日下部 実
出典 平凡社「最新 地学事典」最新 地学事典について 情報
Sponserd by 
イオン強度
稀薄溶液において,イオンの濃度と平均活量係数の関係の尺度となる数値.
出典 朝倉書店栄養・生化学辞典について 情報
Sponserd by 
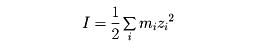
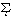 は全イオン種についての合計を示す。溶液中に溶けた、ある注目する電解質のイオンは、もし、その周りにイオン強度Iの多数の陰陽イオンの雰囲気が存在すると、それらから電気的相互作用を受ける。したがって、その挙動の自由さは制限される。その度合いは活動度係数γで表されるが、P・J・W・デバイ(オランダ生まれ。アメリカに帰化)とドイツのE・A・A・J・ヒュッケルは、Iとγの間の定量的関係
は全イオン種についての合計を示す。溶液中に溶けた、ある注目する電解質のイオンは、もし、その周りにイオン強度Iの多数の陰陽イオンの雰囲気が存在すると、それらから電気的相互作用を受ける。したがって、その挙動の自由さは制限される。その度合いは活動度係数γで表されるが、P・J・W・デバイ(オランダ生まれ。アメリカに帰化)とドイツのE・A・A・J・ヒュッケルは、Iとγの間の定量的関係