共役塩基
きょうやくえんき
conjugate base
デンマークのブレンステッドの酸塩基理論によってヒドロン(陽子プロトン1H+と重陽子ジュウテロン2H+=2D+を含むすべての水素イオン)H+を受け取る側となる物質。ヒドロンを与える側はその塩基の共役酸となる。ブレンステッドの酸塩基理論では、酸とはH+を相手に与えるような分子あるいはイオン、塩基とは相手からH+を受け取るような分子あるいはイオンと定義され、酸と塩基は互いにH+を間にして共役する関係にある。この定義に従うと、酸HAが塩基として作用する水H2Oに溶けると、H+は2対の共役酸塩基の間を移動する。
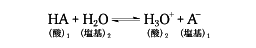
この解離平衡式で右から左への反応に注目すれば、H3O+がA-にH+を与えている。ここで、A-はHAの共役塩基、HAはA-の共役酸であり、H3O+はH2Oの共役酸、H2OはH3O+の共役塩基である。表の第一と第二の例では、水が相手しだいによって酸にも塩基にもなりうることがわかる。第四の例は水の自己酸塩基解離である。
[岩本振武]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
共役塩基
キョウヤクエンキ
conjugate base
ブレンステッドの酸塩基の理論(ブレンステッド酸・塩基)において,酸がプロトンを失ったものを,その酸の共役塩基という.たとえば,酸HAの水溶液での解離,
HA + H2O  H3O+ + A-
H3O+ + A-
において,A- は酸HAの共役塩基であり,また溶媒であるH2Oは酸H3O+の共役塩基である.[別用語参照]共役酸
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
世界大百科事典(旧版)内の共役塩基の言及
【酸・塩基】より
…たとえば実際には次のような場合がある。 酸 塩基 HNO3⇄H++NO3- HC2O4-⇄H++C2O42- NH4+⇄H++NH3 H2SO4⇄H++HSO4- HSO4-⇄H++SO42- HCO3-⇄H++CO32-このときの酸と塩基の関係は互いに共役の関係にあり,酸に対しては共役塩基,塩基に対しては共役酸であるという。たとえば,HNO3のような強酸は,弱い共役塩基NO3-をもち,強い塩基のCO32-は弱い共役酸HCO3-をもつことになる。…
※「共役塩基」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
Sponserd by 
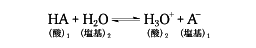



 H3O+ + A-
H3O+ + A-