化学辞典 第2版 「水素の工業的製法」の解説
水素の工業的製法
スイソノコウギョウテキセイホウ
manufacture of hydrogen
水素はアンモニア,メタノールなどの合成工業原料として不可欠で,安価なことが必要である.水素の製法は現在,電解法とガス法とに大別される.【Ⅰ】電解法:アルカリ(または酸)の希薄水溶液を電解し,鉄陰極で水素,ニッケルめっき鉄陽極で酸素を発生させる.石綿で両極を分離してある.60~70 ℃,2 Vで電解し,99.5~99.9% 高純度水素が得られる.【Ⅱ】水性ガス(合成ガス)法:赤熱した炭素(コークス,石炭)により水蒸気を還元すると得られ,H2 + COを主成分とする.
C + O2 → CO2 + 406 kJ (blow工程)
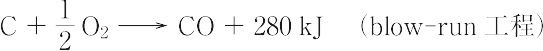
C + H2O → CO + H2 - 130 kJ (run工程)
水性ガス反応は吸熱のためblow工程とrun工程を交互に行い,水性ガスとblowガスを別々に炉から取り出す.水性ガスを洗浄,脱硫後,水蒸気とまぜ,
CO + H2O → H2 + CO2 + 40.2 kJ
の水性ガス転化反応により水素を得る.CO2,CH4などの不純物は深冷分離する.【Ⅲ】コークス炉ガス法:石炭乾留で得られるコークス炉ガスには50% の水素を含むので,不純物を除き,これを直接用いる方法.【Ⅳ】炭化水素の水蒸気変成法:炭化水素(ナフサ,天然ガス,LPGなど)をNi触媒を用い,700~900 ℃ で水蒸気と反応させる.
2CmHn + 2mH2O → 2mCO + (2m + n)H2
【Ⅴ】炭化水素の部分酸化法:炭化水素(ナフサ,天然ガス,重油など)を無触媒(1100~1400 ℃)あるいはNi触媒(700~900 ℃)を用いて部分酸化を行わせる.この場合,一般に水蒸気変成を併用する.
2CmHn + mO2 → 2mCO + nH2
COは水性ガス転化反応により,CO2として除去する.
現在,水素のほとんどは【Ⅳ】,【Ⅴ】の方法により製造されている.[別用語参照]アンモニア合成
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

