翻訳|hydrogen
共同通信ニュース用語解説 「水素」の解説
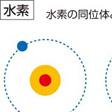
水素
元素の中で最も軽く、水を電気分解して製造できる。燃焼すると酸素と反応して水となり、二酸化炭素(CO2)を排出しない。資源の少ない日本にとって貴重なエネルギーになる可能性がある。CO2を出さずに製造した「グリーン水素」、排出を伴った「グレー水素」などに分けられる。生産や輸送にかかるコストの高さが課題となっている。
更新日:
出典 共同通信社 共同通信ニュース用語解説共同通信ニュース用語解説について 情報
精選版 日本国語大辞典 「水素」の意味・読み・例文・類語
すい‐そ【水素】
- 〘 名詞 〙 最も軽い気体元素。元素記号H 原子番号一。原子量一・〇〇七九四。無色、無味、無臭の気体。天然には水または有機物などの化合物として広く存在する。クラーク数〇・八七で第九位。工業的には水の電解や水性ガスなどでつくる。陽子一個、電子一個から成り、元素中最も簡単な構造をもつ。熱伝導率が高く、熱に対して安定。また分子運動速度が大きく、最も拡散しやすい。一般に常温では不活発だが、温度を上げると多くの元素や化合物と直接反応する。生物学的には、生体内の酸化還元反応にあずかり、有機・無機の水素供与体から他の水素受容体に移動する。アンモニア・塩酸・メタノールなどの合成、油脂の水素添加、液体燃料などに多量に用いられるほか、酸水素炎・気球充填(じゅうてん)ガス・冷却剤などに広く用いられる。
- [初出の実例]「水素と酸素を抱合して水を生ず」(出典:遠西医方名物考補遺(1834)八)
改訂新版 世界大百科事典 「水素」の意味・わかりやすい解説
水素 (すいそ)
hydrogen
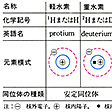
元素の一つ。単体は通常,分子式H2で示される。無色,無臭の最も軽い気体として存在する。自然界に存在する水素は大部分が質量数1のもの(1H)であるが,質量数2のもの(2H)も約0.015%含まれ,後者は重水素あるいはジュウテリウムdeuteriumと呼ばれる。また,放射性同位体である質量数3のもの(3H)は三重水素あるいはトリチウムtritiumと呼ばれるが,2Hと3Hとを合わせて重水素と総称することもある。これらに対し1Hを軽水素あるいはプロチウムprotiumと呼ぶこともある。トリチウムはβ線を出して崩壊する。
はじめて水素をつくり,その性質を研究したのはイギリスのH.キャベンディシュ(1766)である。彼は鉄,亜鉛,スズなどに希硫酸や希塩酸を加えて水素を発生させ,可燃性の軽い気体が発生することを認めた。その後,フランスのA.L.ラボアジエは水を強熱して分解すると同じ気体が得られることを認め(1783),水のもととなる元素という意味でギリシア語のhydōr(水)とgennaō(生む)からhydrogèneと命名した。重水素を発見したのはアメリカのH.C.ユーリーである(1931)。
水素は水圏,気圏をも含めたものとして地殻を考えた場合,その全重量の0.14%を占め,10番目に多い元素である。しかし他の元素と化合しやすいので,その大部分は水をはじめ生物体中の有機化合物など種々の化合物として存在し,遊離の状態では火山の噴気や天然ガス中に見いだされ,またセルロースやタンパク質が細菌によって分解されるときにも生ずるが,その量は全体としてわずかである。
性質
別欄に示すように,水素は融点,沸点がきわめて低く,気体の密度,液体,固体の比重もきわめて小さい。水に対する溶解度も小さいが,アルコールには水よりややよく溶ける。ある種の貴金属・重金属(白金,パラジウム,ニッケル,鉄など)・合金に吸収・保持される,いわゆる〈吸蔵〉現象を起こす特性があり(〈水素吸蔵金属〉の項参照),たとえばパラジウムはその体積の350~850倍の水素を吸蔵して著しく膨張し,かつもろくなる。このような場合,水素の分子はパラジウムの原子の間の空間にもぐりこみ,金属結合を弱めているが,同時に水素の分子自身も著しく変形して,原子状,またはそれに近い状態になっていると想像される。実際,水素を吸蔵したパラジウムを真空中に置くと,普通の水素よりも著しく反応性に富む水素が発生する。パラジウムが水素による還元反応のすぐれた触媒となるのはこのためである。このような原子状またはそれに近い状態の水素は活性水素active hydrogenと呼ばれ,普通の水素に紫外線照射,放電などによって高いエネルギーを与えると生じる。また金属に酸を作用させたり,電気分解によって水素を発生させたりするときにも,発生直後のもの(発生期状態の水素と呼ぶ)はとくに反応性が激しく,一種の活性水素とみられる。
水素は常温では比較的反応しにくい元素で,フッ素以外の元素とは反応しないが,塩素とは光の作用によって爆発的に反応する。高温にすれば多数の元素と化合し,ほぼ次の3種類の水素化物(ハイドライドhydride)をつくる。(1)揮発性水素化物 水H2O,アンモニアNH3,硫化水素H2S,ハロゲン化水素HX(X=F,Cl,Br,I)など,主として非金属元素の水素化物で,共有結合による分子から成り,融点,沸点が低い。(2)食塩型水素化物 アルカリ金属やアルカリ土類金属と水素を強熱すると得られる。NaH,CaH2のような組成の無色の結晶で,融点の高いイオン結晶(Na⁺H⁻,Ca2⁺(H⁻)2など)である。水と反応して水素を発生し,またその融解塩を電解すると陽極に水素を発生するので,水素がH⁻のような陰イオンになっていることがわかる。強い還元剤になる。(3)金属状水素化物 遷移元素の水素化物がこれで,水素の原子があるいは一定の組成をなし(CrH,FeH6など),あるいは不定の組成で(LaH2.76,TaH0.76など)金属原子のすきまに入りこみ,その構造を変形させているものである。固体で,融点が高く,もとの金属の性質をある程度残しているが,比重はそれより小さい。上に述べた水素の吸蔵現象も,この種の化合物の形成の特異な例と考えることもできる。これらの化合物のうち,とくに水やハロゲン化水素のような陰性元素の揮発性水素化物は安定なので,水素を高温の金属酸化物やハロゲン化物と反応させると金属が遊離される。
CuO+H2─→Cu+H2O
VCl2+H2─→V+2HCl
原子,分子,イオンの構造
水素の原子は陽子1個(重水素の場合は陽子,中性子各1個)から成る核があり,そのまわりを1個の電子が半径約0.5Åの球形の電子雲(1s軌道)をなしてとりかこんでいる。水素の分子ではこのような原子が2個結合し,たがいに0.74Å離れた2個の核のまわりを2個の電子が共通の電子雲(σ1S分子軌道)をつくってとりかこんでいる(図参照)。このとき,電子は両方の核の中間の部分に強く引き寄せられるから,電子雲の密度はこの部分でとくに高まり,核どうしの反発作用はこの電子雲によって打ち消されるので,全体としてエネルギーの低い,安定な状態ができる。水素の原子はこのように最も簡単な原子であり,また分子は最も簡単な形の共有結合をもつ分子である。共有結合をつくっている1対の電子は,〈パウリの原理〉に示されるように,つねに反対方向の自転運動(スピン運動)をしていなければならないが,水素分子ではさらに核の陽子もスピンをもっており,この二つの核のスピンがどちらも同方向の場合と,たがいに反対方向のものとが存在し得る。前者をオルト水素ortho-hydrogen,後者をパラ水素para-hydrogenという。常温付近ではオルト水素とパラ水素の比は3対1であってほとんど変化しないが,低温になるとパラ水素のほうが生じやすくなり,極低温で磁性体を触媒に使うなどの方法によれば,ほとんど純粋のパラ水素を得ることも可能になる。オルト水素とパラ水素の差は比熱とその温度変化に著しくあらわれ,沸点などの物性にもわずかな差がある。
このような分子のほか,水素はH⁺,H⁻のようなイオンにもなる。前者は陽子そのものであるが,実際の物質中ではたやすく他の粒子の電子雲の中に引きこまれてこれと共有結合をつくってしまうので,独立の粒子としては存在しない。
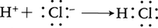 水中のH⁺と呼ばれるものは,実は下のような反応で生じたH3O⁺イオン(オキソニウムイオン)である。
水中のH⁺と呼ばれるものは,実は下のような反応で生じたH3O⁺イオン(オキソニウムイオン)である。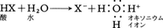 これに反して,H⁻は上に述べた食塩型水素化物の中に実在し,ヘリウム原子Heと同じ電子配列をもつ半径約1.5Åの陰イオンである。しかし核の電荷がHeの1/2しかないために,電子を失いやすい不安定な粒子で,たとえば水分子からH⁺を奪い,これと結合して安定なH2分子に変化する。このように水素は原子の最外部に1個のs電子をもつ点からみればアルカリ金属(第ⅠA族)に,また近くの0族元素よりも1個だけ電子が少ない点からみればハロゲン(第ⅦB族)に似ているが,そのどちらとも異なる特異な元素である。
これに反して,H⁻は上に述べた食塩型水素化物の中に実在し,ヘリウム原子Heと同じ電子配列をもつ半径約1.5Åの陰イオンである。しかし核の電荷がHeの1/2しかないために,電子を失いやすい不安定な粒子で,たとえば水分子からH⁺を奪い,これと結合して安定なH2分子に変化する。このように水素は原子の最外部に1個のs電子をもつ点からみればアルカリ金属(第ⅠA族)に,また近くの0族元素よりも1個だけ電子が少ない点からみればハロゲン(第ⅦB族)に似ているが,そのどちらとも異なる特異な元素である。
実験室での製法
実験室で水素を得るには,次のような方法がある。
(1)亜鉛や鉄のような水素よりもイオン化傾向のやや高い金属に,希硫酸を作用させる。亜鉛が純粋だとかえって水素の発生がよくないことがあるが,このときは硫酸銅溶液を少し加えると,亜鉛の表面に少量の銅が付着して一種の電池ができるので,水素の発生が促進される。
Zn+H2SO4─→ZnSO4+H2
(2)ナトリウム,カリウムのように,イオン化傾向がさらに大きい金属に水を作用させる。これらの金属は冷水を激しく分解し,水素を発生させる。
2Na+2H2O─→2NaOH+H2
(3)亜鉛やアルミニウムは(1)の反応で酸に溶けて水素を発生させるが,また濃厚な水酸化ナトリウム水溶液のような強アルカリ性の溶液にも溶け,やはり水素を発生させる。ケイ素は非金属だが,同様に強アルカリ性溶液から水素を発生させる。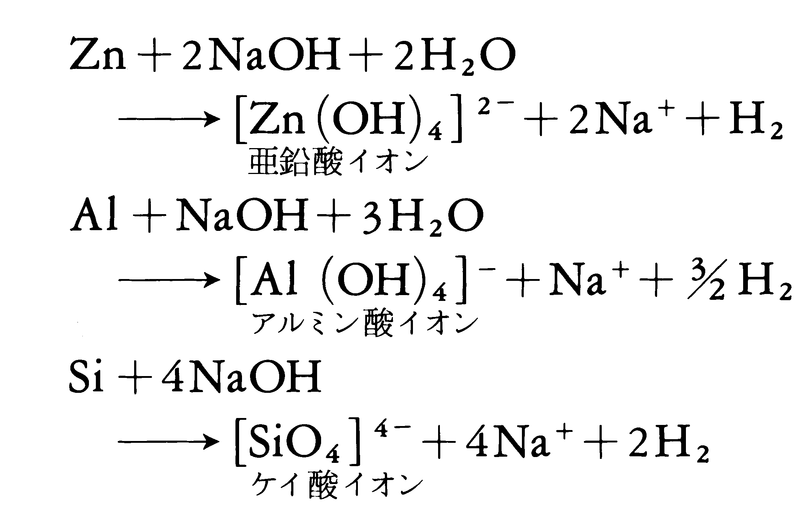
(4)水の電気分解。実験室的な方法では,水酸化ナトリウムの20%水溶液を白金,ニッケル,鉛,炭素などの電極を用いて分解するか,希硫酸を白金,炭素などの電極を用いて分解する。どちらの場合も水だけが分解される。
2H2O─→2H2+O2
(5)野外などで,軽量な材料から簡単に水素を得るには,水素化カルシウムCaH2と水との反応
CaH2+2H2O─→Ca(OH)2+2H2
を用いることもある。
執筆者:曽根 興三
工業的製法
工業的な水素の製造は,かつては水の電気分解,石炭またはコークスなどの固体燃料を用いて大規模に行われていた。水電解法はよく知られた方法であるが,電力価格の上昇により現在はほとんど工業的には行われていない。1molの水を電解するのに2ファラデーの電気量を必要とし,1molの水素と1/2molの酸素を生成する。理論分解電圧は1.23Vであるが,実際は電極材料の加電圧により1.5V以上の電圧を要する。ただ生成水素は純度が高く精製の必要はない。石炭のガス化法は石炭あるいはコークスに水蒸気を通して1500℃程度の高温で反応させ,H2とCO2の混合した水性ガスを得る方法であるが,石炭から石油燃料への変化に伴い,この方法も現在ではあまり行われていない。
現在は,天然ガス,LPG(プロパン,ブタン),石油精製廃ガス,ナフサ,原油などの気体および液体炭化水素が原料として用いられるようになり,製造法は水蒸気改質法と部分酸化法がおもに行われている。
(1)接触水蒸気改質法 原料炭化水素を水蒸気とともに触媒上で反応させ,H2,CO,CO2とする。反応条件は700~1000℃,10~40気圧で,ニッケル触媒が用いられる。 水素とともに生成するCOは,さらに水蒸気と反応して次式のようにCO2まで転化する。
水素とともに生成するCOは,さらに水蒸気と反応して次式のようにCO2まで転化する。
CO+H2O─→H2+CO2
原料炭化水素が硫黄を含む場合は触媒の被毒が著しいので,水蒸気改質反応に先立って脱硫過程を必要とする。脱硫は5%程度の水素を添加し,約300℃でCo-Mn系触媒上で反応させ,硫黄分を硫化水素とする。次にZnO触媒で還元して硫黄として除去する。原料炭化水素には,かつてはナフサが多く使われたが,現在は天然ガスを用いるところが多い。
(2)加圧非接触部分酸化法 この方法は水蒸気改質法に比べ原料の脱硫を要しないという利点がある。さらに気体から液体燃料までの幅広い炭化水素を原料として用いることが可能である。主反応は,予熱した酸素により1300~1400℃で次のように進行する。 生成するCOは水蒸気改質法と同様に水蒸気と反応させてCO2に転化する。部分酸化法は純度95%以上の酸素を反応に用いるので,空気分離装置を必要とし,設備投資を高くするので,石油廃ガスや原油を原料として使用することが有利な場所で多く用いられる。
生成するCOは水蒸気改質法と同様に水蒸気と反応させてCO2に転化する。部分酸化法は純度95%以上の酸素を反応に用いるので,空気分離装置を必要とし,設備投資を高くするので,石油廃ガスや原油を原料として使用することが有利な場所で多く用いられる。
用途
アンモニアおよびメチルアルコール合成用原料,石油精製における水素化分解用に多量に用いられる。さらに近年はロケット用燃料,宇宙空間飛行体用燃料としても用いられるようになってきた。
執筆者:本多 健一
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「水素」の意味・わかりやすい解説
水素
すいそ
hydrogen
周期表中第1周期、第1番元素である。第1族および第17族に属する元素に似たところがあり、短周期型周期表ではⅠ族およびⅦ族の両方に属させるか、あるいはその特異性を重視して、いずれの族にも含めず、独立した扱いをとることがある。同位体として質量数2および3のもの(重水素)が存在するが、ほかの元素の場合と異なり、普通の水素原子(重水素に対し軽水素、プロチウムという)の2倍、3倍というように質量の差が甚だしく、その性質の違いも大きい。それゆえ、質量数2の水素を重水素あるいはジュウテリウム(Dまたは2H)、質量数3の水素を三重水素あるいはトリチウム(Tまたは3H)とよぶ。
[守永健一・中原勝儼]
歴史
1766年、イギリスのキャベンディッシュにより、酸と金属から得られる可燃性の気体として確認された。当時信じられていたフロギストン説に従って、彼は初めこの軽い気体をフロギストンと考えたが、1781年にこの気体が燃えて水のみを生じることを自分で確かめてからは、このものが水とフロギストンとの化合物であると考えるようになった。これを正しく元素として認識したのはフランスのラボアジエであった。すなわち、1783年、灼熱(しゃくねつ)した鉄管中に水蒸気を通して水を分解し、水が元素ではないことを明らかにするとともに、得られた気体が元素であるとして、この気体に「水の素」(フランス名hydrogène)と名づけた。ギリシア語でhydroは水、gennaoはつくるの意味である。元素記号Hはラテン名hydrogeniumの頭文字である。アメリカのH・C・ユーリーらは1933年、水の電解を繰り返して重水素を発見した。また翌1934年オリファントMarcus Laurence Elwin Oliphant(1901―2000)らは、重水素化合物にジュウテロンを衝撃させて初めてトリチウムをつくった。1950年には大気中にトリチウムが検出された。
[守永健一・中原勝儼]
存在
宇宙全体では水素はもっとも多量に存在する。単体は全物質中もっとも軽く、したがって地球の上層大気には多く集まり下層部分ではきわめて少なく、乾燥空気は約5×10-5容量%の水素を含むだけである。単体水素は火山の噴気、天然ガス中などに存在するが、地球表面では酸素と化合した水の形で、岩石圏(結晶水など)、水圏(海水、大陸氷など)、気圏および生物圏にわたって広く存在している。水素は各種の星、あるいは星間物質としても存在し、宇宙空間に広く分布し、宇宙全体の総原子数の約93%を占める。また、水素は他のすべての元素の出発物質でもある。
[守永健一・中原勝儼]
製法
工業的には、石油、石炭、天然ガスなどを酸素または空気、水蒸気などと高温で反応させて合成ガス(一酸化炭素と水素の混合物)をつくり、これから水素を取り出す。そのほか、1000℃以上に熱した炭素に水蒸気を通して得られる水性ガスからの分離、炭化水素の熱分解、塩水の電気分解などが利用される。実験室では、亜鉛に希塩酸または希硫酸を反応させてつくるか、水酸化アルカリまたは硫酸の水溶液を電気分解してつくる。電解法では比較的純粋な水素が得られやすいが、亜鉛と酸を用いる方法では不純物(アルシン、ホスフィン、硫化水素、炭化水素など)が含まれやすい。市販の赤色ボンベに入っている水素は、普通99.5%以上の純度があり、通常の目的にはそのまま使用して差し支えない。重水素は重水を電気分解して工業的につくられている。
[守永健一・中原勝儼]
構造
水素原子はもっとも簡単な原子で、原子核(陽子1個)と電子1個からなる。ジュウテリウムは原子核に中性子1個、トリチウムは2個の中性子をもつ。これらは沸点、融点などの物理的性質だけでなく、化学的反応性にもいくぶんか差がみられる。トリチウムは放射性で、電子を放出して自然に崩壊する。
[守永健一・中原勝儼]
性質
水素は常温で無色、無味、無臭の気体。つねに二原子分子H2として存在する。ただし化学反応や電気分解などによって発生する瞬間の水素の活性状態(いわゆる発生期の水素)や水素の低圧放電管内では原子状水素として存在する。水素分子の2個の原子核(陽子)はそれぞれ自転しているので、自転の方向が同じであるオルト水素と、反対であるパラ水素という異性体がある。常温では、オルト水素75%とパラ水素25%の混合物であり、温度を下げていくとパラ水素の割合が増えていく(たとえば-193.1℃:48.35%、-253.1℃:99.8%)。
水素分子は分子量がもっとも小さく、そのためすべての気体のなかでもっとも軽く、同じ温度での分子速度は、すべての気体のなかでいちばん大きい。このため熱伝導率も空気の約7倍と大きく、冷却効果が優れている。常温では反応性に乏しく、直接化合するのはフッ素だけである。塩素とは光の作用のもとに爆発的に化合する。1:1混合物は塩素爆鳴気とよばれている。しかし、高温では活性となり、多くの金属、非金属元素と化合して水素化物をつくる。金属によっては、水素の分圧が高いとき吸収し、低くなるとふたたび放出するものがある(たとえばパラジウム、ニッケルなど)。水素と酸素との混合物は常温では安定であるが、550℃以上に熱するか、火花あるいは炎など、また適当な触媒の存在で、多量の熱を発して反応し水を生成する。とくに2:1混合物は爆鳴気とよばれ、もっとも激しく爆発する。空気中あるいは酸素中では炎をあげて燃え、水を生成する。金属酸化物と熱すると還元して金属を生じる。また、触媒があると、不飽和有機化合物と水素化(水素添加)などの反応をおこす。
[守永健一・中原勝儼]
用途
アンモニア合成、石油化学工業に関連した各種の水素化反応(分解、異性化、脱硫など)、油脂の水素添加、塩化水素や触媒などの製造、燃料電池、酸水素炎(約2500℃)として金属の溶接・切断などに、液体水素は低温実験用の冷却剤として用いられる。これらのなかで近年もっとも注目されるのは、エネルギーとしての用途である。水素は、燃えれば水となり環境汚染を生じないことから燃料電池その他に用いられる。また液体水素は低温実験用の冷却剤として用いられる。
[守永健一・中原勝儼]
水素(データノート)
すいそでーたのーと
水素
元素記号 H
原子番号 1
原子量 1.00794±7
融点 -259.14℃
沸点 -252.87℃
比重 液体,0.0708(測定温度-253℃)
固体,0.076(測定温度-260℃)
密度 気体,0.08987g/dm3
(0℃,1気圧)
結晶系 固体,正方
溶解度 1.82mL/100mL(水20℃)
臨界温度 -240.17℃
臨界圧 12.76気圧
定積比熱(cp) 3.396cal・deg-1g-1(20℃)
定圧比熱(cv) 2.404cal・deg-1g-1(18℃)
cp/cv 1.407(17℃)
蒸発熱 108~114cal/g(20.4K)
融解熱 14cal/g
熱伝導率 4.12×10-5cal・
cm-1sec-1deg-1(0℃)
元素存在度 宇宙 2.6×1010(第1位)
(Si106個当りの原子数)
地殻 1.4mg/g(第10位)
海水 0.11×109μg/dm3
化学辞典 第2版 「水素」の解説
水素
スイソ
hydrogen
H.原子番号1の元素.原子量1.00794(7).質量数1(99.9885(70)%)と2(0.0115(70)%)の2種の安定同位体と,半減期12.32 y,質量数3の β- 崩壊・同位体核種がある.1783年,A. Lavoisier(ラボアジエ)がギリシア語の“水”を意味する δωρ(hyd
δωρ(hyd r)と“生成する”を意味するγεινομαι(geinomai)から,水を造る気体としてhydrogèneと命名した.英語名はhydrogen.ドイツ語名Wasserstoff,オランダ語名Waterstofはともに“水の素”を意味し,蘭学者宇田川榕菴はW. Henryの著書Experimental Chemistry(1799年)のオランダ語訳の和訳書「舎密開宗」(1837年)で,水素瓦斯(ワートルストフガス,喜度羅厄涅(ヒードロゲ子))とよんでいる.質量数2の同位体は重水素(ジュウテリウム),3のものは三重水素(トリチウム)とよばれ,質量数1のものは区別するため,軽水素(プロチウム)とよばれることもある.プロトンは 1H+(=陽子),天然の同位体混合物としての水素イオンの二つの意味で使われてきたが,IUPACは後者をヒドロンとよぶように勧告している.1776年にH. Cavendish(キャベンディッシュ)によって元素として確認された.
r)と“生成する”を意味するγεινομαι(geinomai)から,水を造る気体としてhydrogèneと命名した.英語名はhydrogen.ドイツ語名Wasserstoff,オランダ語名Waterstofはともに“水の素”を意味し,蘭学者宇田川榕菴はW. Henryの著書Experimental Chemistry(1799年)のオランダ語訳の和訳書「舎密開宗」(1837年)で,水素瓦斯(ワートルストフガス,喜度羅厄涅(ヒードロゲ子))とよんでいる.質量数2の同位体は重水素(ジュウテリウム),3のものは三重水素(トリチウム)とよばれ,質量数1のものは区別するため,軽水素(プロチウム)とよばれることもある.プロトンは 1H+(=陽子),天然の同位体混合物としての水素イオンの二つの意味で使われてきたが,IUPACは後者をヒドロンとよぶように勧告している.1776年にH. Cavendish(キャベンディッシュ)によって元素として確認された.
宇宙にもっとも多く存在する元素で,原子組成90% 以上,重量組成でも75% 余りを占める.太陽,そのほかの恒星で核融合反応により,エネルギーとヘリウム以上の重元素を生成している.地球上では主として水の形で存在する.水素の単体は H2 分子を形づくっている.工業的には天然ガス,液化石油ガスなどの水蒸気改質,水の電解,コークスのガス化(水性ガス)などにより得られる.実験室では亜鉛,アルミニウム,鉄などに塩酸または希硫酸を注いでつくられる.単体の性質は,気体は無味,無臭,無色で,液体も無色である.融点-259.14 ℃,沸点-252.87 ℃.臨界温度-240.0 ℃.密度0.0708 g cm-3(液体-253 ℃).結合間隔0.0741 nm.水そのほかの溶媒には溶けにくいが,パラジウム,白金,ニッケルなどには大量に吸蔵される.水素分子には,水素原子核のスピンの向きによりオルトとパラの2種類がある.常温ではおおよそオルト3:パラ1の比になっている.化学的には常温では比較的不活発で,フッ素とのみ直接反応する.塩素との反応は光を当てると連鎖的に進行する.酸素との混合物は常温では安定であるが,点火すると爆発的に水になる.これ以外の非金属元素とは加熱,触媒使用,放電などにより化合する.アルカリ金属およびアルカリ土類金属とは高温で直接化合して水素化物をつくる.同じく高温で金属酸化物を還元して金属を遊離する.H-H結合の解離エネルギーは432.07 kJ mol-1 で,高温でも H2 分子の解離度は小さい(1000 ℃,4×10-7 %,3000 ℃,9.0%).H原子の生成熱ΔfH°gas218.00 kJ mol-1.放電などにより分子を解離して水素原子をつくると,きわめて活性となる.金属に酸を作用させた瞬間に発生する水素も反応性が比較的大きく発生期の水素とよばれる.アンモニア,メタノール,塩酸の合成原料,油脂類の水素添加などに大量に使用される.液体水素は宇宙船の燃料,冷媒としても重要である.[CAS 1333-74-0][別用語参照]水素の工業的製法
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「水素」の意味・わかりやすい解説
水素
すいそ
hydrogen
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「水素」の意味・わかりやすい解説
水素【すいそ】
→関連項目水素菌|太陽
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「水素」の解説
水素
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...