内科学 第10版 「原発性肺腫瘍」の解説
原発性肺腫瘍(肺腫瘍)
原発性肺腫瘍では良性腫瘍は少なく,ほとんどが悪性腫瘍であり,肺胞および気管,気管支の上皮細胞を起源として発生する上皮性悪性腫瘍が大部分を占める.非上皮性である肉腫はまれである.
疫学
肺癌による死亡数は年々増加しており,2011年のわが国の肺癌による死亡者数は70272人(全悪性腫瘍死亡数の19.7%),男女別では,男性50767人(同23.8%),女性19505人(同13.7%)である.男性の粗死亡率・罹患率は女性の約2.5倍である.罹患数と死亡数に大きな差はなく,肺癌罹患者の生存率は低い(5年生存率:15~20%の間).年齢階級別死亡率・罹患率ともに50歳代後半から高齢になるにつれて上昇する.
病因
肺癌の発症を促進する因子として最も重要なのは喫煙である.タバコ煙中にはベンツピレンをはじめとする多くの発癌物質が含まれている.非喫煙者に対する喫煙者の肺癌リスクは,日本人を対象とした疫学研究のメタ解析では,男性で4.4倍,女性で2.8倍と高い.組織型別では,扁平上皮癌で男性12倍,女性11倍,腺癌で男性2.3倍,女性1.4倍と大きな差がある.喫煙が肺癌の発生に寄与する割合は,日本では男性で68%,女性で18%程度と推計されている.また,受動喫煙も肺癌リスクを20~30%程度上昇させる.
アスベスト,シリカ,ヒ素,クロム,コールタール,放射線,ディーゼル排ガス,ラドンなどへの職業的・一般環境的暴露が肺癌のリスク要因として報告されている.特に,アスベスト暴露による悪性中皮腫や肺癌の発生は増加の傾向にある.
遺伝子異常
肺癌の遺伝子異常としては,癌遺伝子のMYC遺伝子の増幅,K-RAS遺伝子の突然変異による活性化,癌抑制遺伝子のRB遺伝子やP53遺伝子の突然変異による不活性化をはじめ,種々の遺伝子異常が報告されている(表7-12-1).
病理
肺癌の組織型は多様であり,WHO分類あるいは日本肺癌学会分類が用いられている.組織型別にみた肺癌の頻度は,腺癌(ほぼ40%),扁平上皮癌(三十数%),小細胞癌(15%程度),大細胞癌(5%程度)の4種類で全体の90~97%を占めている.
しかし近年,腺癌の比率が年々高くなっている.組織型による肺癌の病理学的ならびに臨床的特徴を表7-12-2に示した.
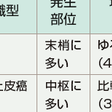
1)小細胞肺癌(small cell lung cancer:SCLC):
肺門部にも発生するが,末梢肺に原発巣が存在することが多い(図7-12-1).気管支壁内に沿って増殖進展することが多く,無気肺,閉塞性肺炎の合併は少ない.小細胞肺癌は細胞増殖が速く,血行性転移やリンパ行性転移を起こしやすいため,診断時に胸部X線上小結節影であってもその多くが遠隔転移を起こしており進行癌となっている.
特殊型として,混合型小細胞癌(combined small cell carcinoma)がある.小細胞癌に加え,非小細胞癌の成分を含む癌で,合併する組織型としては,腺癌,扁平上皮癌,大細胞癌が多い.肉腫様成分を含む場合もある.
2)非小細胞肺癌(non-small cell lung cancer:NSCLC):
a)扁平上皮癌(squamous cell carcinoma): 喫煙との因果関係が最も強く,男性に好発する.肺門部に発生することが多く,ポリープや結節様の増殖を示すことから内腔の狭窄や閉塞を伴い二次的な無気肺や閉塞性肺炎を合併する(図7-12-2). 組織学的には,角化ないし角化傾向を示す細胞および細胞間橋を示す細胞からなる癌である.角化,細胞間橋の有無,扁平化の程度を指標として,高分化,中分化,低分化に分類している.
b)腺癌(adenocarcinoma): 日本では最も多い肺癌であり全肺癌の40%以上を占める.男女比は2:1と男性に多いが,女性の全肺癌患者の約70%が腺癌である.腺癌発生は肺末梢部に多く(図7-12-3),中枢での発生は少ない.
組織学的には腺房型(acinar),乳頭型(papillary),細気管支肺胞上皮型(bronchioloalveolar),粘液産生充実型(solid carcinoma with mucous formation)に分類されている.細気管支肺胞上皮癌型の腫瘍細胞は既存の肺胞構造を破壊せずにこれに沿って,置換性の増殖を示し,間質や血管,胸膜への浸潤を示さない.腺癌は分化度によって高分化,中分化,低分化と細分類されている. c)大細胞癌(large cell carcinoma):約90%は亜区域支より末梢に発生し,周囲肺組織を圧排し増殖する.男女比は4~5:1である.末梢発生であるが,胸膜播種はきわめてまれである.増殖は速く,約半数は診断時にすでに転移を認める. 組織学的には明瞭な核小体をもつ大型の核と中~大の細胞質を有する大型の細胞からなり,扁平上皮癌に特徴的な角化や細胞間橋を欠き,腺癌に特徴的な腺腔形成や乳頭状構造を示さない未分化な充実性胞巣を形成する癌である.
d)その他の肺癌: ⅰ)カルチノイド(carcinoid):APUD(amine precursor uptake decarboxylase)系細胞ないしはKultchizky細胞に由来する低悪性度の悪性腫瘍で,全肺腫瘍の1~2%を占める.発生部位は肺門部に多く,約90%にみられる.診断時年齢は40~50歳代が多く,ほかの肺癌に比べて若年発生である. ⅱ)気管支腺由来低悪性度腫瘍:気管支腺を発生母地とし,発育はゆっくりで気管支腔内にポリープ状に増殖することが多い.局所での進展が中心で,遠隔転移はほとんどない.若年者に好発するが,性差はない.代表的なものとして,腺様囊胞癌(adenoid cystic carcinoma)と粘表皮癌(mucoepidermoid carcinoma)があげられる. ⅲ)多形,肉腫様あるいは肉腫成分を含む癌:肉腫様あるいは肉腫成分を含む低分化な非小細胞癌で,紡錘細胞あるいは巨細胞を含む癌(多形癌,紡錘細胞癌,巨細胞癌),癌肉腫,肺芽腫を含む.上皮と間葉への分化を示す.
臨床症状
症状は原発性肺腫瘍の発生部位に大きく影響され,大きく中枢性(肺門領域)と末梢性(肺野領域)に分けられる.初診時の自覚症状と頻度を表7-12-3に示した.しかし,早期肺癌では症状に乏しく,臨床病期Ⅰ,Ⅱ期では約60%は無症状である.
中枢側に発生する扁平上皮癌は増殖に伴い,上皮層から深部へ浸潤したり,気道腔内へポリープ状に腫瘍を形成して狭窄を起こすので,気道刺激による咳,分泌亢進による痰がみられる.ときに,完全閉塞により無気肺を併発することもある.感染(たとえば閉塞性肺炎)を続発すると発熱が加わる.また,太い気管支内での腫瘍形成は,気道狭窄による喘鳴様症状を訴える.小細胞癌も主として気管支の粘膜下を長軸方向に沿って肺門部へと進展するので,気道の周囲の組織が肥厚し画像上トラムラインの所見としてみられることがある.また,扁平上皮癌と同様に狭窄性病変を形成することもある. 末梢性に発生する肺腫瘍は,中枢性に比べて頻度が高く,腺癌に多い.大細胞癌は末梢部か中間部に発生し,孤立性の大きな結節・腫瘤影として発見されることが多い. いずれの組織型においても,血管への侵襲,血管透過性の亢進,腫瘍血管の増殖などがあり,さらに咳による気道内圧の変化が加わると血痰,喀血をきたしやすい. 上大静脈症候群では,頸部,上腕などの該当領域の浮腫や表在性静脈の拡張が顕著になる.腫瘍随伴症候群(paraneoplastic syndrome) 原発腫瘍巣や転移巣の部位から離れた部位に生じる宿主の臓器機能障害と定義される.発症機序としては,①腫瘍が症状を惹起する物質を産生する,②腫瘍による正常物質の代謝ないし消費,③腫瘍に対する宿主の反応,があげられる.
1)骨関節症状:
ばち指は,肺,心,肝疾患などでみられるが,原発性肺癌,特に扁平上皮癌や特発性間質性肺炎でよく認められる.また,肥大性骨関節症は長管骨の骨膜増生や骨膜の不整肥厚,上下肢の腫脹疼痛,関節痛,ばち指を主症状とする症候群である.一般に,腺癌,扁平上皮癌に合併することが多い.
2)神経学的腫瘍随伴症候群:
腫瘍に随伴する神経筋症状で肺癌に合併することが最も多いが,頻度的には約1%である.腫瘍と神経組織の共通抗原に対する免疫反応(液性免疫[抗体],細胞性免疫)による.①大脳皮質変性症,②亜急性小脳変性症,③腫瘍随伴性脳脊髄炎,④亜急性知覚ニューロン症,⑤Lambert-Eaton筋無力症候群,⑥皮膚筋炎,などの病型がある.
3)異所性ホルモン産生による症状:
通常,ホルモンを産生しない正常な細胞が腫瘍化に伴って産生することがあり,異所性ホルモン産生腫瘍とよばれる.肺癌,特に小細胞癌はその頻度が高く,種々のホルモンを過剰産生して多彩な症状を呈する.たとえば,異所性ACTH産生によるCushing症候群,カルチノイド症候群,また異所性ADH(antidiuretic hormone)産生によるADH不適合分泌症候群(syndrome of inappropriate secretion of ADH:SIADH)は小細胞肺癌でよくみられる.一方,高カルシウム血症は癌患者の10~20%にみられ,機序としては腫瘍のPTHrP(parathyroid hormone-related peptide)産生,融解性骨転移局所のサイトカイン・PTHrP産生,腫瘍のcalcitriol産生が知られている.
4)サイトカイン産生による症状:
大細胞癌や腺癌ではG-CSF(granulocyte colony stimulating factor),M-CSF(macrophage CSF),GM-CSFなどの造血因子産生を示すことがあり,患者末梢血での著明な白血球増加がみられる.またそれらの肺癌ではIL-6産生を伴うことが多く,フィブリノゲン,CRPの上昇や血小板増加症がみられることがある.
診断
肺癌の診断には,病理組織学的あるいは細胞診断学的診断が必須であり,さらに種々の検査を組み合わせて肺癌の浸潤,転移の広がりを検索し,TNM分類・病期を決定する.肺癌の診断的アプローチは図7-12-4のように,非観血的検査から観血的検査へと順次進めていく.
1)画像検査:
a)胸部X線検査:肺門,縦隔領域は胸部X線像では盲点となりやすい.また,中心性の早期肺癌(たとえば扁平上皮癌)では症状を欠き,胸部X線上も無所見であることが多い.早期に所属肺門リンパ節,縦隔リンパ節に転移し,原発巣と腫脹したリンパ節が集合した陰影としてみられる.一方,末梢発生の肺癌は検診やほかの病気で受診中に発見される場合が多い.高分化型の腺癌,特に細気管支肺胞上皮癌(bronchioloalveolar carcinoma)では細気管支肺胞上皮置換性の増殖様式を取るため,X線上は結節・腫瘤影というよりは辺縁不鮮明な淡い濃度上昇を示す斑状影を呈する.末梢型腺癌の進展様式でもう1つの特徴は胸膜への浸潤が高い頻度でみられることである.原発性腫瘍が小さいと自覚症状もほとんどなく,胸膜炎として発見される例もある.一般に,癌性胸膜炎症例の50~70%は肺腺癌が原因である.また,大細胞癌は孤立性の大腫瘤状を呈することが多く,X線上は境界鮮明で周囲組織への浸潤が比較的少ないのが特徴である.
b)胸部CT:胸部X線では発見されない肺野型の小型肺癌(10 mm以内)がCT検査にて診断可能である.縦隔リンパ節や肺門リンパ節の検出や病変部の血流動態なども把握できる.
c)MRI:腫瘍の局所進展の検索に用いられる.大動脈などの大血管,胸椎,胸郭入口部への腫瘍浸潤の有無を確かめるのに有用である. d)PET:ラジオアイソトープで標識したFDG([F-18]-2-fluoro-2-deoxy-d-glucose)を用いたPET(positron emission tomography)が肺癌の診断に用いられ,さらに,CTと同時に撮影できるPET(PET/CT)も登場し,悪性腫瘍の部位・形態診断と性質(悪性度)診断,転移巣や再発巣の診断に用いられている.また,治療効果判定における有用性も示されている.
2)喀痰細胞診検査:
肺癌検診として,年齢が50歳以上で喫煙指数(1日の喫煙本数×喫煙年数)が600以上の者など,肺門部肺癌の高危険群に対して胸部X線検査とともに行う.また,胸部X線検査で肺癌が疑われた場合,最低3日間の蓄痰か3日間の連続採痰を行う.喀痰細胞診による陽性率は,肺門部肺癌で70~80%,肺野型肺癌で30~50%である.
3)気管支鏡検査:
肺癌診断にとって欠かせない検査である.気管支ファイバースコープで気道内腔を観察し,病巣部より生検鉗子,ブラシなどで検体を採取し,病理組織診および細胞診を行う.気管支鏡結果は,気管支鏡所見分類に従い記載する.腫瘍の増殖形態より,粘膜型(肺門型の扁平上皮癌),粘膜下型(末梢発生の扁平上皮癌,腺癌,大細胞癌,小細胞癌),壁外型に分類されている.また,バーチャルナビゲーションを用いた極細径気管支鏡検査,超音波気管支鏡検査などの開発によって,末梢肺野の微小な病変やリンパ節に対しても生検が可能になっている.
4)経皮的針生検:
腫瘍病巣が肺末梢部にあり,胸壁に浸潤もしくは接していると気管支鏡検査などで確定診断ができないことがある.その場合に胸壁からの針生検を行うことがある.胸部X線像,CT像,超音波エコー像を参考にして穿刺部を決定する.
5)開胸肺生検,胸腔鏡検査:
上記検査法にて確定診断がつかず画像上から肺癌が強く疑われる場合には開胸肺生検を行う.一方最近,術中術後の患者負担を軽減する目的に胸腔鏡下での肺切除術が急速に発展しており,末梢部の肺癌の切除が可能になっている.
6)腫瘍マーカー:
肺癌に特異的な腫瘍マーカーは現在のところない.肺癌の腫瘍マーカーは癌進展時期に陽性率が高くなることから,早期肺癌の診断には有用性に乏しい.しかし,異常高値である場合には,治療効果の評価,経過観察による再燃の予知という点で有用性が高い(表7-12-4).
a)CEA(carcinoembryonic antigen):腺癌で高値を示すことが多く,臨床で最も汎用される腫瘍マーカーである.
b)SCC(squamous cell carcinoma related antigen):扁平上皮癌に特異性が高い.
c)NSE(neuron specific enolase):小細胞肺癌の腫瘍マーカーとして特異性が高い.NSEは神経組織に特異性の高い酵素であり,神経内分泌腫瘍で多量に産生される.血清NSEの異常高値はNSE含有細胞からの酵素逸脱に由来する. d)CYFRA(cytokeratin 19 fragment)21-1:サイトケラチンは細胞骨格のうち中間径フィラメントを構成する蛋白質群の1つであり,上皮細胞の分化に特異的な蛋白質である.サイトケラチン19の発現は肺癌に特異性が高い. e)ProGRP(pro-gastrin releasing peptide):小細胞肺癌細胞から産生される3種類のProGRPを定量する測定系(カットオフ値:46 pg/mL)が確立され,約65.5%と比較的高い陽性率を示し,非小細胞肺癌では10%以下である.
7)遺伝子検査:
進行(Ⅳ期)非小細胞肺癌では,上皮成長因子受容体遺伝子検査を行い,遺伝子変異の有無を検査する.これによって,上皮成長因子受容体チロシンキナーゼ阻害薬の感受性を予測し,治療適応を検討する.
病期分類
非小細胞肺癌の病期診断は,組織診断や各種の画像診断をもとに癌病変の進展範囲を決定し,治療方針の決定(表7-12-5)や予後の推測に大きな役割を果たしている.リンパ節転移の検索には画像診断法が用いられ,肺門・縦隔リンパ節転移の診断には胸部CTが役立つ.遠隔転移の検索として,脳転移にはMRIあるいはCTが用いられる.肺内転移の診断にはCTがすぐれている.骨転移診断には骨シンチグラムが有用であるが,骨折部位や関節症でも集積がみられることから,骨CT・MRI・X線像やPET/CTを参考にして判定する.小細胞肺癌は骨髄への転移頻度が高いため,胸骨もしくは腸骨稜からの骨髄穿刺が行われる.
1)TNM病期分類:
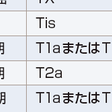
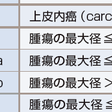
TNM病期分類は2009年にUICC(世界対がん連合)/IASLC(世界肺癌学会)によって第7版改訂がなされ,日本肺癌学会も採用して,日本国内でも広く用いられている(表7-12-6).第7版改訂のおもな改定点は,①T因子が細分化され,T1がT1aとT1bに,T2がT2aとT2bとなり,7 cmをこえる腫瘍はT2からT3に変更,②肺内結節は同一肺葉内がT4からT3に,同側他肺葉内がM1からT4に,対側肺内がM1からM1aに変更,③胸膜播種,悪性胸水,心囊水がT4からM1aに,遠隔転移がM1からM1bになったことである.また病期分類も変更された.
2)小細胞肺癌の病期分類:
小細胞肺癌は早期に広範囲な遠隔臓器への転移を生じるため,手術適応となることはまれであるが,臨床病期の決定は治療法の選択や予後の判定に最も重要である.小細胞肺癌ではTNM分類よりも,病変の広がり方から一側胸郭内に腫瘍が限局した胸郭内限局型(limited disease:LD)と遠隔転移を伴った全身播種型(extensive disease:ED)とに分類され(表7-12-7),根治的胸部放射線治療の対象となるLD症例の選択を目的とした分類となっている.
治療・予後
肺癌は,多様な組織型を示し,それぞれが分子生物学的特性を異にするだけでなく,リンパ行性・血行性転移の頻度が高く,診断時にすでに遠隔転移が存在し,進行癌であることも多い.また,発症年齢が高いことから合併症や全身の臓器機能の低下があることも多い.したがって,治療法を選択するうえで最も重要な因子は,臨床病期,全身状態(performance status:PS),臓器機能,合併症,年齢であり,それらを考慮して治療方針が決定される.小細胞肺癌と進行・再発非小細胞肺癌の治療は肺癌に有効とされる抗癌薬を組み合わせた併用化学療法が主体となる.進行・再発肺癌の治療目標は,①生存期間の延長と②症状緩和や症状出現の遅延・予防をはかりQOLを改善・維持することにある.
臨床試験において抗癌薬を含む治療の客観的な腫瘍縮小効果を判定する基準として,RECIST(response evaluation criteria in solid tumors)(WHO改訂版)が使われている.治療前のすべての標的病変の最長径の和を算出しベースライン長径和として,治療後の縮小率を算出する.完全奏効(complete response)は治療後すべての病変が消失,部分奏効(partial response)は30%以上減少,進行(progressive disease)は20%以上増加とし,安定(stable disease)は進行でも部分奏効でもない状態をいう.
1)小細胞肺癌:
診断時,すでにリンパ行性,血行性に遠隔転移(微小転移を含む)をきたしていることが多く,全身化学療法が治療の主体となるが,Ⅰ期症例に限ると,外科療法に術後化学療法を併用することにより5年生存率が50~70%と良好である.発見時,症例の60~70%はEDであり,LD症例は30~40%である.しかし,小細胞肺癌は抗癌薬,放射線照射に対する感受性が高い.化学療法によるLD症例の奏効率は80~90%であり,ED症例は約70%である. a)LD小細胞肺癌:治療目標は治癒であり,Ⅰ期を除くLD症例においては,化学療法と放射線療法の併用療法が推奨されている.全身状態が良好(PS 0-1)で呼吸機能,腎機能をはじめ全身の臓器機能が保たれている70歳以下の症例においては,化学療法として4コースのPE(シスプラチン+エトポシド)療法と加速多分割照射による胸部放射線療法(1日2回照射,45 Gy/30回/3週)の同時併用療法が標準治療である.この治療法で現在,20~25%の症例が治癒可能となっている.完全奏効(CR)が得られた症例では,脳の微小転移巣の根絶を目的に,予防的全脳照射(prophylactic cranial irradiation:PCI)を追加することによって生存期間の延長が得られる. b)ED小細胞肺癌:全身化学療法が第一選択となる.化学療法で延命効果が得られることから積極的に行われる.放射線療法は症状緩和目的に使用される.化学療法として,PI(シスプラチン+イリノテカン)療法4コース,あるいはPE療法4コースが標準治療になっている.ED症例の予後はきわめて不良であり,中間生存期間は9~13カ月であり,3年以上の長期生存率は1%以下である. c)再発癌:再発小細胞癌では,初回化学療法が奏効し,かつ初回化学療法終了から再発までの期間が長い症例(一般に3カ月以上)は感受性再発とされ,初回化学療法と同一の薬剤,または初回治療で用いられなかった薬剤(アムルビシン,イリノテカン,トポテカンなど)で奏効が期待される.一方,初回化学療法が無効,または初回化学療法終了から再発までの期間が短い症例(一般に3カ月以内)は治療抵抗性再発とされ,二次化学療法の効果が小さく予後不良である.二次化学療法としては,初回治療で用いられなかった薬剤が用いられる.
2)非小細胞肺癌:
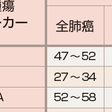
抗癌薬による化学療法,放射線療法に対する感受性は低く,根治的な治療法は現時点では,胸腔内限局例に対する完全切除以外にないとされるため,治療方針決定では手術療法適応の有無がまず評価される(表7-12-5).標準的な術式は,肺葉切除に肺門・縦隔リンパ節郭清である.しかし,病期の進展した症例に対しては完全切除が不可能であり,抗癌薬(化学療法)および分子標的治療薬を含む薬物療法や放射線療法が主体となる.非小細胞肺癌全体の5年生存率は40%台で,病期ⅠA期症例では良好であるが,病期の進行とともに低下し,多くを占めるⅢ,Ⅳ期症例の予後はきわめて悪い(表7-12-8). a)Ⅰ期非小細胞肺癌:手術療法が第一選択となる.病理病期ⅠA期症例に限れば,手術成績は5年生存率80~90%となる.病理病期ⅠB期では術後補助化学療法(テガフール・ウラシル配合剤UFT)が標準治療となっている.合併症や年齢(高齢)のために手術不能の場合には肺原発巣に対する定位放射線治療が行われる.
b)Ⅱ期非小細胞肺癌:手術療法が第一選択となる.完全切除後の術後補助化学療法によって予後改善が期待できるとする大規模比較臨床試験が複数報告されたことから,病理病期ⅠB,Ⅱ,ⅢA期の完全切除例では術後補助化学療法が行われる(病理病期Ⅱ,ⅢA期ではシスプラチン併用化学療法). c)Ⅲ期非小細胞肺癌:さまざまな進展様式を呈する症例を含んでいる.集学的治療の対象となるが,いまだ確立した治療法はなく,臨床研究の対象となっている.術前の化学療法(あるいは化学放射線療法)と手術療法を行う集学的治療が研究されているが,確立するには至っていない.ⅢA期とⅢB期とに分類される.ⅢA期はリンパ節転移の広がりによって予後がかなり異なり,N2群の予後は悪い.したがって,ⅢA期でもN0・N1群で完全切除可能であれば手術療法が選択される.手術不能ⅢA期とⅢB期で腫瘍進展が根治的放射線照射可能な領域に限局していれば,化学療法と胸部放射線療法との併用療法が行われる.根治的放射線照射が不可能な症例では薬物療法が行われる.放射線照射によって肺臓炎,食道炎などの有害事象を生ずるため,間質性肺炎などを合併する症例では放射線療法の選択には慎重な配慮が求められる. d)Ⅳ期非小細胞肺癌:すでに遠隔転移を認め,進行期にあることから薬物療法が選択される.癌性胸水を主体とする症例では,胸水コントロール(胸水ドレナージ,胸膜癒着術)を行い,その後に薬物療法を行う.1980年頃にシスプラチンが導入され,1990年代には第3世代抗癌薬として,ビノレルビン,イリノテカン,パクリタキセル,ドセタキセル,ゲムシタビンなどが登場し,また2000年代に新規抗癌薬として開発されたペメトレキセドが開発され,生存期間の延長に貢献しているが,成績はいまだ不良である.これらの抗癌薬は白金製剤(シスプラチン,カルボプラチン)と組み合わせて用いる場合が多い(併用療法).Ⅳ期を対象とした抗癌薬併用療法成績から,奏効率30~40%,中間生存期間11~15カ月,1年生存率40~60%との成績が得られ,現時点ではどのような抗癌薬を組み合わせても延命効果にほとんど差がみられないことが判明している.抗癌薬の組み合わせにより有害事象の種類や発生頻度が異なることから,併存する合併症を考慮し,QOL保持ならびに生存期間延長効果という観点から評価を行い,最適な抗癌薬を選択する必要がある.ペメトレキセドは,シスプラチンとの併用療法において,腺癌・大細胞癌で扁平上皮癌に比して,有意に生存期間を延長したため,非扁平上皮癌(腺癌・大細胞癌)で用いられる.
2000年代前半に非小細胞肺癌に対する新しい治療薬として,肺癌の悪性度にかかわる上皮成長因子受容体(epidermal growth factor receptor:EGFR)チロシンキナーゼを標的とする分子標的治療薬ゲフィチニブが登場したが,EGFR遺伝子に遺伝子変異を有する癌(おもに腺癌)で著効し,奏効率60~80%,中間生存期間25~30カ月,1年生存率80%程度と,EGFR遺伝子変異陽性肺癌患者の生存期間を著しく延長した.一方で重篤な肺障害が数%の頻度で出現し社会問題化した.新しい遺伝子異常として,EML4-ALK融合遺伝子の形成が非小細胞肺癌の3~5%(おもに腺癌)に認められ,ALK阻害薬(クリゾチニブ)が奏効率約60%と著効する.その他の分子標的治療薬では,血管内皮成長因子に対する抗体薬(ベバシズマブ)が開発され,白金製剤併用化学療法との併用で非扁平上皮癌の標準治療の1つになっている.また,新しい分子標的治療薬の開発も進んでおり,今後の展開が期待される.
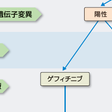
図7-12-5に,進行(Ⅳ期)非小細胞肺癌の薬物療法・治療方針を示した.腫瘍組織あるいは腫瘍細胞のEGFR遺伝子検査を行い,遺伝子変異陽性の場合には,一次治療または二次治療でゲフィチニブを考慮する.EGFR遺伝子変異陰性の場合には,非扁平上皮癌(腺癌・大細胞癌)では白金製剤併用化学療法,白金製剤併用化学療法+ベバシズマブを考慮する.また,EGFR遺伝子変異陰性の扁平上皮癌の場合には白金製剤併用化学療法を考慮する.
3)肺癌合併症に対する治療:
a)癌性胸水:肺癌の胸腔内への進展により胸水がしばしば貯留する.胸水貯留のコントロールをするかどうかは臨床症状の有無で決定するが,小細胞肺癌の場合は化学療法の効果が期待できるため全身化学療法を優先して行う.非小細胞肺癌の場合は,胸水貯留側に胸腔ドレーンを挿入して低圧持続吸引を行う.急速に排液を行うと長時間虚脱していた肺が急膨張し肺水腫の原因となることから十分な注意を要する.排液が50 mL/日以下になれば,薬物(OK-432,アドリアマイシン,シスプラチン,ブレオマイシンなど)を注入し胸膜を癒着させる. b)癌性心膜炎:癌性心膜炎は心タンポナーデを併発しやすいことから,早期に治療を行う必要がある.治療法は対症的であるが,通常,剣状突起下を切開してドレーンを挿入して心膜液を排液する.排液後再貯留する場合や数日のドレナージによっても排液が持続する場合には薬物を注入する.
c)脳転移:脳転移は種々の脳神経症状や脳圧亢進症状を呈して問題となる.治療としては,全脳照射や定位照射などの放射線療法が中心となる.特に小細胞肺癌による脳転移に対しては全脳照射の奏効率が高い.条件によって,手術療法も適応となる.脳転移病巣周囲には脳浮腫が生じ,圧迫症状を呈することがあるため,副腎ホルモン剤の投与やマンニトール,高張グリセリンなどの浸透圧利尿薬を併用する. d)骨転移:骨転移は疼痛や病的骨折,神経麻痺などのために患者QOLを著しく低下させる.治療としては,放射線療法,骨転移治療薬のビスホスホネート製剤やRANKL抗体薬の投与が行われる.ストロンチウム(89Sr)も用いられる.
e)癌性疼痛:肺癌は難治癌の代表的なものの1つで,症状緩和療法によって患者のQOLを良好に保つことは重要である.そのなかで最も重要なのが疼痛緩和である.[秋田弘俊]
■文献
日本肺癌学会:肺癌取扱い規約,第7版,金原出版,東京,2010.
Sawabata N, Asamura H et al: Japanese lung cancer registry study: first prospective enrollment of a large number of surgical and nonsurgical cases in 2002. J Thorac Oncol, 5: 1369-1375, 2010.
出典 内科学 第10版内科学 第10版について 情報