内科学 第10版 の解説
ステロイドホルモンの生合成・分泌・代謝(副腎皮質)
ステロイドホルモンは共通構造として3個の六員環(A,B,C環)と1個の五員環(D環)からなるcyclopentanoperhydrophenanthrene環構造をもつ.炭素原子は図12-6-6に示す番号で命名される.また,炭素原子の位置はC-5,炭素原子の数はC21のように表す.各ステロイドホルモンは炭素数により,グルコおよびミネラルコルチコイドで代表されるプレグナン(pregnane:C21),男性ホルモンであるアンドロスタン(androstane:C19),女性ホルモンであるエストラン(estrane:C18)の3種に分類される.二重結合はΔ(デルタ)で表し,位置は二重結合を形成する2つの炭素原子のうち,下位の番号で示す.
ステロイドホルモンは副腎,精巣,卵巣および胎盤で産生され,各器官に特異的に発現する酵素により各器官に特有のホルモンを生合成,分泌する.また,グルココルチコイド,性ステロイドの合成,分泌は下垂体前葉より分泌される刺激ホルモンにより調節されているが,ミネラルコルチコイドはおもにレニン-アンジオテンシン系により調節されている.
a.副腎皮質ステロイドホルモンの生合成
副腎皮質の球状層からミネラル(鉱質)コルチコイドのアルドステロン,束状層と網状層からグルココルチコイドのコルチゾールと弱いアンドロゲンであるデヒドロエピアンドロステロン(DHEA)が分泌される.ヒトの血中に高濃度に存在するDHEA-SはスルホトランスフェラーゼによりDHEAに硫酸基が付加したものである.スルホトランスフェラーゼ活性は末梢組織,特に肝に強く,副腎ではおもに網状層に限局している.
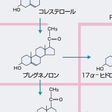
すべてのステロイドホルモンはコレステロールから合成され,ヒトの副腎皮質ではその80%は血中の低比重リポ蛋白(LDL)から,20%はアセチルコエンザイムAからのde novo合成により供給される.供給されたコレステロールのうちステロイド合成に利用されないものはコレステロールエステルとして脂肪顆粒に蓄積される.すべてのステロイドホルモンの生合成の律速段階はコレステロールのプレグネノロン(pregnenolone)への変換である.この段階は副腎皮質では副腎皮質刺激ホルモンACTH,精巣,卵巣では黄体化ホルモンLHにより刺激される.この刺激機構の本体は遊離コレステロールのミトコンドリア外膜から内膜への移送である.刺激ホルモンにより上昇した細胞内cAMPがセカンドメッセンジャーとなりコレステロールエステラーゼを活性化,細胞内脂肪顆粒よりコレステロールを遊離させる.遊離したコレステロールはsterol carrier protein 2(SCP2)などにより速やかにミトコンドリア外膜へ移送される.cAMPは一方で代謝回転の非常に速い分子量3万のsteroidogenic acute regulatory protein(StAR)の合成を促進し,StARの作用により遊離コレステロールがミトコンドリア外膜から内膜へ転送される.いったん,ミトコンドリア内膜へ移送された遊離コレステロールはミトコンドリア内膜に局在するチトクロームP450SCC(コレステロール側鎖切断酵素)により速やかにC21ステロイドのプレグネノロンに変換され,以降の移送や各酵素による反応も速やかに進行する(図12-6-7).すなわち,プレグネノロンはミクロソームに存在する3β-ヒドロキシステロイドデヒドロゲナーゼ(3β-hydroxysteroid dehydrogenase/isomerase:3β-HSD)により3β-OHが酸化,さらにΔ5がΔ4へ転換され,プロゲステロン(progesterone)となる.副腎と性腺で発現している3β-HSDは2型である.ミクロソームに存在するチトクロームP450C17(17α-ヒドロキシラーゼ)はプロゲステロンあるいはプレグネノロンのC-17を水酸化し,それぞれ17α-ヒドロキシプロゲステロン(17α-hydroxyprogesterone),17α-ヒドロキシプレグネノロン(17α-hydroxypregnenolone)へ変換する.これらはさらに,同一のP450C17によりC17-C20の切断反応(C17, 20-リアーゼ作用)を受け,それぞれC19ステロイドであるアンドロステンジオン(androstenedione)とDHEAに変換される.ヒトのP450C17はΔ5系のリアーゼ反応に特異的である.すなわち,17α-ヒドロキシプレグネノロンからDHEAへの変換を触媒する. 17α-ヒドロキシプレグネノロンやDHEAは3β-HSDにより,それぞれ17α-ヒドロキシプロゲステロン,アンドロステンジオンに変換されうる.プロゲステロンと17α-ヒドロキシプロゲステロンはさらに,ミクロソームに局在するチトクロームP450C21(21-ヒドロキシラーゼ)によりC-21の水酸化を受け,それぞれデオキシコルチコステロン(deoxycorticosterone:DOC),11-デオキシコルチゾール(11-deoxycortisol(S))へ変換される.DOCとSはさらに,ミトコンドリアに局在するP45011β(11β-ヒドロキシラーゼ)によりC-11の水酸化を受け,それぞれコルチコステロン(corticosterone(B))とコルチゾール(cortisol(F))に変換される.副腎皮質球状層ではP450C17を欠くためプレグネノロンからプロゲステロン,ついでDOCが合成される.球状層にはP45011βと相同性の高いP450aldo(aldosterone synthase,アルドステロン合成酵素)が発現しており,P450aldo単一酵素によりDOCはBへ,さらにBはC-18の水酸化を受け18-ヒドロキシコルチコステロン(18-hydroxycorticosterone:18-OH-B)となり,さらに18位が酸化されてアルデヒド基となりアルドステロンが合成される.ヒトのP45011βはBから18-OH-Bへの転換能はもつが,アルドステロンへの転換は触媒しない.束状層の細胞にはP45011β,球状層の細胞にはP450aldoが発現しており,P45011βとP450aldoの両方を発現する細胞は存在しないのでコルチゾールとアルドステロンの合成は層により完全に区別されている.
b.精巣におけるステロイドホルモンの生合成
男性ホルモン(アンドロゲン,androgen)であるテストステロン(testosterone)は精巣のLeydig細胞(間質細胞)で合成,分泌される.テストステロン合成の律速段階は副腎皮質と同様,LHによりStARが合成され,コレステロールがミトコンドリア内膜へ転送されるステップである.C19ステロイド合成はヒトではΔ5系が主要経路であり(ほかの動物ではΔ4系が主),プレグネノロン,17α-ヒドロキシプレグネノロン,DHEAへと合成され,DHEAはミクロソームに局在する17β-ヒドロキシステロイドデヒドロゲナーゼ(17β-hydroxysteroid dehydrogenase:17β-HSD)によりC-17が水酸化され,アンドロステンジオールΔ5-androstenediolとなり3β-HSDによりテストステロンが合成される(図12-6-7).精巣でテストステロン合成に関与するのはⅢ型17β-HSDである.テストステロンは標的組織で5α-リダクターゼ(5α-reductase)によりA環の還元を受けより活性の高いジヒドロテストステロン(dihydrotestosterone:DHT)へ変換されて作用する.Wolff管の副睾丸や輸精管への分化はテストステロンで起こるが完全な男性型外生殖器への分化はDHTの作用が必須である.各C19ステロイドのアンドロゲン作用の強さの比はDHT:テストステロン:アンドロステンジオン:DHEA=60:20:2:1である.
c.卵巣におけるステロイドホルモンの生合成
卵巣では卵胞を形成する顆粒膜細胞(granulosa cell)と夾膜細胞(theca cell)の2種の細胞の協同作用によりC21ステロイドとしてプロゲステロン,C19ステロイドとしてアンドロステンジオン,C18ステロイドとしてエストロゲン(estrogen)が合成される.これらのステロイドホルモンの合成酵素の発現はLH,FSH分泌に依存するため卵胞のステロイド合成は月経周期により大きく変動する.卵胞期の卵巣では夾膜細胞でヒトではΔ5系によりプレグネノロン,17α-ヒドロキシプレグネノロン,DHEAと合成され,DHEAが3β-HSDによりアンドロステンジオンへ変換される.このアンドロステンジオンは顆粒膜細胞へ移り,FSHで発現が誘導されるチトクロームP450AROM(アロマターゼ,aromatase)によりA環の芳香環化とC-19の離脱反応を受けエストロン(estrone)へ変換される.さらに,17β-HSDにより,最もエストロゲン活性の強い17β-エストラジオール(17β-estradiol)が合成される(図12-6-7).排卵後,黄体期になるとP450SCCと3β-HSDの発現が顆粒膜,夾膜両細胞で亢進するためプロゲステロン産生が増加する.一方,黄体期になると顆粒膜細胞が増殖(granulosa-lutein cell)するとともにP450AROMの発現が亢進しエストラジオール合成が増加する.卵胞期,黄体期を通じてP450C17は顆粒膜細胞には発現されず,また,P450AROMと17β-HSDは顆粒膜細胞にのみ発現されるので,エストロゲンは顆粒膜細胞からのみ,プロゲステロンは黄体期の顆粒膜,夾膜両細胞から,アンドロステンジオンは夾膜細胞からのみ分泌されることになる.
d.卵巣以外でのエストロゲン合成の役割
P450AROMは卵巣以外に皮膚,脂肪組織,骨組織,肝臓,脳,胎盤など広範囲の組織で発現している.末梢でのテストステロンからエストラジオールへの転換の大部分は脂肪組織のP450AROMによる.男性の先天性アロマターゼ欠損症では骨端線の閉鎖がみられず高身長となり骨密度が低下し骨粗鬆症となる.また,インスリン抵抗性,高中性脂肪血症,低HDLコレステロール血症などの脂質と糖の代謝異常を認める.これらの異常はエストラジオールの投与により是正されるので,男女問わず,骨の成熟と維持,脂質・糖代謝にはエストロゲンが必須である.
(2)ステロイドホルモンの代謝
a.コルチゾール,アルドステロンの代謝
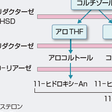
コルチゾール(F)は11β-ヒドロキシステロイドデヒドロゲナーゼ(11β-hydroxysteroid dehydrogenase:11β-HSD)により11位が酸化され不活性型のコルチゾン(cortisone(E))となる.11β-HSDには肝,肺,精巣で発現しているⅠ型(11β-HSD1)と腎,大腸,胎盤で発現しているⅡ型(11β-HSD2)がある.Ⅰ型は双方向性の反応を触媒するが,生体内ではコルチゾンをコルチゾールへ変換する反応が強いためグルココルチコイド作用を増強する酵素である.コルチゾールのコルチゾンへの変換は一部肝でも起こるが大部分は腎で行われる.腎尿細管のミネラルコルチコイド受容体はコルチゾールとアルドステロン両方に対して親和性を示すがコルチゾンには結合活性を示さない.コルチゾールの血中濃度はアルドステロンの1000倍であるにもかかわらず,コルチゾールが生体内でミネラルコルチコイド作用を示さないのは,腎で11β-HSD2によりコルチゾールがコルチゾンへと不活化されているためで,この機構によりアルドステロンのミネラルコルチコイド受容体への特異性が維持されている.
コルチゾールは主として肝で代謝される.まず,Δ4が還元されることにより不活性化される.この反応を触媒する酵素はC-5に付加される水素の立体位置が5α(allo体)となるもの(5α-リダクターゼ),5β体となるもの(5β-リダクターゼ)があり,ヒトでは5β-リダクターゼが主となる.ついで,3α-ヒドロキシステロイドデヒドロゲナーゼ(3α-hydroxysteroid dehydrogenase:3α-HSD)により3位のケト基が還元(水酸化)され,テトラヒドロコルチゾール(tetrahydrocortisol:THF)となり,A環が完全に還元される(図12-6-7,12-6-8).コルチゾンも同様の代謝を受けテトラヒドロコルチゾン(tetrahydrocortisone:THE)となる.THFやTHEはさらに20-ケトリダクターゼ(20-ketoreductase)によりC-20が還元され,コルトール(cortol),コルトロン(cortolone),さらに,肝C17, 20-リアーゼによりC17-C20が切断されC19ステロイドの11-ヒドロキシエチオコラノロン(11-hydroxyetiocholanolone),11-ケトエチオコラノロン(11-ketoetiocholanolone)となる.以上の種々の代謝物は抱合を受けて尿中に排泄される(図12-6-8).THF,THE,コルトロンは尿中のコルチゾール全代謝物のなかでそれぞれ約20%を占める.アルドステロンは肝でA環の還元を受けテトラヒドロアルドステロン(tetrahydroaldosterone)となり抱合を受け尿中へ排泄されるものが35~40%を占め,腎で直接18位がグルクロン酸抱合されて(aldosterone-18-glucuronide, 3 oxo-conjugate)尿中へ排泄されるものが約10%を占める.ステロイドホルモン中間生成物の尿中代謝物としてはプロゲステロンに由来するプレグナンジオール(pregnanediol),17α-ヒドロキシプロゲステロンに由来するプレグナントリオール(pregnanetriol)がある.
b.アンドロゲン,エストロゲンの代謝
DHEA-Sはそのまま尿中へ排泄される.DHEAやテストステロンは大部分が肝で代謝され,DHEAは肝の3β-HSDにより,テストステロンは肝の17β-HSDによりアンドロステンジオンに変換された後,A環の還元を受け,エチオコラノロン(etiocholanolone,5α体),アンドロステロン(androsterone,5β体)となり抱合を受け尿中へ排泄される(図12-6-8).エストロゲンは最終的には肝で16αの水酸化を受けエストリオール(estriol)となり,抱合化され胆汁中や尿中へ排泄され一部は腸肝循環へ入る.
(3)ステロイドホルモンの分泌量,血中濃度と尿中排泄量
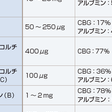
アルドステロンを除き(約30~50%が非結合型)ステロイドホルモンは血中では大部分がコルチコステロイド結合蛋白(corticosteroid-binding globulin:CBG)(コルチゾール,アルドステロンを結合),アルブミン,性ホルモン結合蛋白(sex hormone-binding globulin:SHBG)(アンドロゲン,エストロゲンを結合)などの蛋白に結合して存在する.血中コルチゾールは日内変動があり,血中アルドステロンは体位,食塩摂取,月経周期で異なる.また,DHEA-S,DHEA濃度は20歳以上は年齢とともに減少する.正常婦人の血中テストステロンの起源は40~50%が副腎,卵巣から直接分泌されたもの,50~60%が末梢組織でアンドロステンジオンから変換されたものである.テストステロン,アンドロステンジオンは卵巣,副腎よりほぼ等量分泌される.
17-OHCS(17-hydroxycorticosteroid)は,C-17位に水酸基をもつステロイドのうちC-17位の側鎖がジヒドロキシアセトン(dihydroxyacetone,17α,21-OH,20-ケト)となっているものの総称であり,11-デオキシコルチゾール,コルチゾール,コルチゾン,THF,THEなどが含まれる.ジヒドロキシアセトン側鎖はPorter-Silber反応で検出され,コルチゾールの1日分泌量の20~30%が尿中17-OHCSとして測定される.分泌されたコルチゾールの約1%は代謝を受けずに尿中に排泄され遊離コルチゾール(free cortisol)と称される.遊離コルチゾールの1日分泌量は17-OHCSと異なり,代謝酵素の影響を受けないのでコルチゾール分泌量のよい指標となる.17-KS(17-ケトステロイド)はC-17位にケトン基をもつ中性C19ステロイドの総称でZimmermann反応で検出される.17-KSは11-オキシ-17-KSと11-デオキシ-17-KSに大別され,17-KS 2分画とよばれる(図12-6-8).11-オキシ-17-KSはコルチゾールが11-ヒドロキシあるいは11-ケト型のアンドロステロン(An)やエチオコラノロン(Et)に代謝されたもので全17-KSの約20%を占める.11-デオキシ-17-KSはおもにDHEAやDHEA-Sが,一部は副腎および精巣由来のアンドロステンジオンや精巣由来のテストステロンがAnやEtに代謝されたものである.DHEA-SやDHEAの一部は抱合型としてそのまま排泄される.したがって,11-オキシ-17-KSは11-ヒドロキシ-An,11-ヒドロキシ-Et,11-ケト-An,11-ケト-Etの4分画がおもなもので,11-デオキシ-17-KSは主としてDHEA,Et,Anの3分画より構成され,以上を合わせて17-KS 7分画とよぶ.男性では尿中17-KSのうち精巣に由来するものは20~30%で残りは副腎由来となる.一方,小児や女性ではほとんどが副腎由来で,その大部分がDHEA,DHEA-S由来となる.表12-6-1に各ステロイドの分泌量,結合蛋白との結合率,血中濃度,尿中排泄量を示す.[髙栁涼一]
■文献
Stewart PM, Krone NP: The adrenal cortex. In: Williams Textbook of Endocrinology, 12th ed (Melmed S, Polonsky KS, et al ed), pp479-496, Saunders, Philadelphia, 2011.
出典 内科学 第10版内科学 第10版について 情報