化学辞典 第2版 「交換積分」の解説
交換積分
コウカンセキブン
exchange integral
2個の電子の交換にもとづくエネルギー積分.水素分子の共有結合形成についてのハイトラー-ロンドンの理論のなかで,はじめて導入された積分であり,
∬ ψa*(1)ψb*(2)(H - 2Eh)ψa(2)ψb(1)dτ1dτ2
なる形をしている.ここで,ψa,ψb は水素原子a,bに対する1s軌道関数,Hは二つの1s電子のハミルトニアン,Eh は1s電子のエネルギーである.この交換積分によって表されるエネルギーは,交換エネルギーとよばれ,古典電磁気学では説明しにくいエネルギーである.水素分子の平衡結合間隔付近では,上記の積分値は負であるから,水素分子の安定化エネルギーは,交換積分の値の大きさによってほぼ決定され,水素分子の結合の本質は交換エネルギーにあることが証明された.上記の積分のなかには,
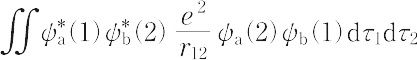
の形の積分が含まれているが,この積分も交換積分といわれ,つねに正の値をもつ.なお,ハイトラー-ロンドンの理論に端を発した原子価結合法(VB法)で多原子分子を取り扱うときには,
∫ ΨⅠ*HΨⅡdτ
の形の積分を交換積分という.ただし,ΨⅠ,ΨⅡは異なった正準構造Ⅰ,Ⅱに対する波動関数,Hは分子の全ハミルトニアンである.また,このような正準構造間の積分を原子軌道(ψa,ψb,…)間の積分まで分解したときに現れる,
∫ ψa*(1)ψb*(2)ψc*(3)…H(1,2,3,…)
× ψb(1)ψa(2)ψc(3)…dτ
の形の積分も交換積分といわれる.この場合には,原子軌道関数が一組だけ置換されるときには単一交換積分,一つ以上の置換があるときには多重交換積分という.原子軌道間の重なり積分が無視できるときには多重交換積分は0となり,単一交換積分のみが残る.単一交換積分の値は,分子でみられる原子間距離ではいつも負の値である.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

