内科学 第10版 「呼吸管理」の解説
呼吸管理(治療学総論)
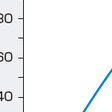
呼吸管理とは呼吸器系の最も重要な働きであるガス交換が適切に行われ,その結果,血液ガス(PaO2,PaCO2,pH)が正常に保たれるようにすることである.したがって,呼吸管理の対象となる病態のほとんどは呼吸不全である.呼吸不全とは大気吸入下でPaO2<60 mmHgの状態を指し,PaCO2の値によりⅠ型とⅡ型に分類される.PaO2<60 mmHgになると,動脈血中に溶存している酸素だけでなく赤血球中のヘモグロビンと結合している酸素の量も急激に低下するため,絶対的な酸素不足を呈する.PaO2<60 mmHgでヘモグロビンと結合する酸素が急激に低下するのは,酸素解離曲線(図3-1-28)の特性のためで,全体としての酸素の含量が著明に低下し生命の危機に直結する.
PaCO2<45 mmHgの呼吸不全をⅠ型呼吸不全,PaCO2>45 mmHgの呼吸不全をⅡ型呼吸不全とよぶが,両者はその発生メカニズムが大きく異なっている.前者では①拡散障害,②シャント,③換気・血流の不均等が低酸素血症の原因であり,後者では肺胞低換気が原因である.肺胞気動脈血酸素分圧較差(alveolar-arterial oxygen pressure difference:A-aDO2)の算出は両者の鑑別に有用で,A-aDO2>10〜20 mmHgと開大している場合には前述の①〜③が呼吸不全の原因であり,開大していなければ肺胞低換気が原因である.肺胞気酸素分圧(PAO2)は,肺胞気式,150−PaCO2/0.8から算出し,A-aDO2(PAO2−PaO2)の正常値は10〜20 mmHgである.また,肺胞換気式PaCO2=0.863×VCO2/VA(VCO2:二酸化炭素産生量,VA:肺胞換気量)から,PaCO2は二酸化炭素産生量と肺胞換気に依存していることがわかる.通常の環境では二酸化炭素産生量は変化しないため,PaCO2は肺胞換気に大きく依存し,PaCO2の上昇の原因は肺胞での換気の低下と考えてよい.このようにⅠ型とⅡ型ではその発症メカニズムが大きく異なるため治療においても原因を考慮しての呼吸管理が重要である.
(2)低酸素血症と低酸素症
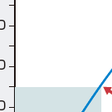
呼吸管理の基本は血液ガスを正常域に保つことであるが,なかでも,PaO2を一定に保つことが最優先である.PaO2の低下は低酸素血症(hypoxemia)とよばれ,低酸素血症の悪化は生命の危機に直結する(図3-1-29).生命の維持には各臓器への酸素供給が十分に保たれていなければならない.したがって,最も重要なことは各組織(臓器)に供給される酸素の量であり,これが低下している状態を低酸素症(hypoxia)とよぶ.各組織へ供給される酸素の量は酸素輸送能とよばれ以下の式により求まる.
Q:心拍出量,Hb:ヘモグロビン,SaO2:酸素飽和度. ここで( )内は100 mLの血液中に存在する酸素の量(酸素含量)を表す.1 gのヘモグロビンは1.34 mLの酸素と結合でき,血液中に溶解している酸素の量はPaO2に定数である0.003を掛ければ求められる.この酸素含量に心拍出量のQを掛けたものが酸素輸送能である.この式から,低酸素血症があれば,必ず低酸素症が存在するが,低酸素血症がなくとも低酸素症はありうるということがわかる.すなわち,上式の変数であるQかHbが低下しても低酸素症は起こりうる.したがって,呼吸管理といえどもPaO2の是正だけを目指すのではなく,最終的な目的はこの酸素輸送能を保ち,低酸素症を改善することであるのを忘れてはならない.
(3)Ⅰ型呼吸不全の治療
Ⅰ型呼吸不全では,A-aDO2が開大しPaCO2は上昇しない.これは,肺胞の換気は十分に行われているが酸素化が障害されていることを表す.したがって,治療は低酸素血症の是正であり酸素療法が治療の主体となる.
a.酸素療法
一般的に,酸素療法の適応はPaO2<60 mmHgの呼吸不全であるが,特に急性の場合には70 mmHg以下で用いてもよい.酸素の投与法にはハイフローシステムとローフローシステムがあるが,急性期の酸素投与にはハイフローシステムの方がすぐれている.一般的に酸素療法で使用されるのは,酸素マスクや鼻カヌラなどのローフローシステムである場合が多い.これらは簡便でほとんどの施設に備えられているため使用されることが多いが,この方法には大きな欠点がある.それは患者が吸入する酸素の量を決定できない点である.たとえば,酸素マスクでは,毎分2 Lや3 Lの投与などの単位で使用されるが,これでは正確にどの程度の酸素量が患者に供給されているかが不明である.それは,患者が吸入する酸素量は患者の換気量に依存するためである.すなわち,患者の換気量が大きければ患者が実際に吸入する酸素量は少なくなり,逆に換気量が小さければ吸入量は多くなる.薬物療法におけるg,mgに相当するのは酸素療法では吸入気酸素濃度(FIO2)であり,FIO2を決定できるのはベンチュリーマスクを代表とするハイフローシステムである.このシステムでは,患者は100%酸素と空気の混合気を吸入するため高流量(40 L/分以上)となるが,患者の換気量にかかわらず一定のFIO2を得ることができる.呼吸不全の急性期では,患者の呼吸状態は不安定であるため,最初は酸素療法をハイフローシステムで開始し,呼吸状態が安定したら,患者にとって楽なローフローシステムに変えてやればよい.ローフローシステムにおいても,呼吸が表3-1-27に示すような安定した状態であれば,FIO2を規定することが可能である(表3-1-28).
慢性呼吸不全の急性増悪は日常臨床でよく遭遇する病態であるが,このときの酸素療法は注意を要する.PaCO2の上昇がなく換気が十分に保たれていれば酸素投与に大きな問題はない.多くはFIO2:30〜40%で低酸素血症は改善するため,その後FIO2を徐々に減らし,呼吸状態が安定したら,鼻カヌラなど患者にとって楽な方法に切り替える.一方,PaCO2が上昇傾向で,肺胞の低換気が疑われる場合には,後述するCO2ナルコーシスを避けるため慎重な酸素投与が必要である.低濃度酸素投与から開始し,PaCO2が上昇しないようにPaO2の改善をはかるcontrolled oxygen therapyを行った方が安全である.
慢性呼吸不全に対し最も成功した呼吸管理法は長期酸素療法であろう.わが国では在宅酸素療法(HOT)とよばれ,自宅で24時間酸素を吸入させる治療法である.PaO2<55 mmHgの慢性呼吸不全患者に対して適応され図3-1-30に示すように長期予後の改善が認められている.通常は鼻カヌラを用いてPaO2が60〜70 mmHgになるように0.5〜2 L/分の酸素を24時間吸入する.この治療法により,多くの呼吸不全患者が在宅での生活が可能となり,社会復帰も可能となった.これまでに約15万人の患者がその恩恵に浴している.現在では,適応が肺高血圧症,55<PaO2<60 mmHgで睡眠時や運動時に増悪する患者,特殊な条件の心不全患者などに拡大されている.
酸素療法の限界はFIO2:50 〜60%と考えた方がよい.これ以上の高濃度の酸素は現実的に投与が難しいが,リザーバーつき酸素マスクでは厳密ではないが60%以上の高濃度酸素の投与が可能である.50%の酸素でも改善がみられないときは酸素療法の限界であり人工呼吸を含めたほかの方法への変更を考慮する.
b.人工呼吸器による治療
Ⅰ型呼吸不全の最重症型は急性呼吸促迫症候群(acute respiratory distress syndrome:ARDS)である.敗血症や多発外傷,重度の肺炎などが原因で肺に広汎な損傷が起こり著しい低酸素血症を呈する.その病態生理は非心原性の透過性肺水腫であり,低酸素が惹起されるメカニズムはシャントの増大である.肺胞は重度の肺水腫によりほとんどガス交換が不能になるため静脈血が低酸素のまま動脈血となりPaO2は低下する.通常の酸素療法ではPaO2の改善が望めず,気管内挿管・人工呼吸が必要になることが多い.ARDSの診断には,P/F 比(PaO2/FiO2)が用いられ,PaO2/FIO2<200 mmHgをARDS,それより軽症でPaO2/FIO2<300 mmHgを急性肺傷害(acute lung injury:ALI)と診断することが欧米のガイドラインで定まっている.ARDS/ALIのようなシャントが原因の重篤な低酸素血症は,通常の50〜60%の酸素投与では改善せず,しばしば人工呼吸の適応となる.人工呼吸下では60%以上の酸素投与が可能であるが,70%以上の酸素の長期投与は禁忌であるため(致命的な肺損傷が惹起されるため),しばしばPEEP(positive end-expiratory pressure,呼気終末陽圧換気)を用いて酸素化を是正し,酸素濃度を低下させる方法が行われる.PEEPとは呼気の終末に5〜15 cmH2Oの陽圧をかけることにより肺胞の虚脱を防ぎガス交換を是正して低酸素状態を改善させる方法である.この方法は,低酸素の改善にきわめて有効で,PEEPを導入して酸素化を是正し,酸素濃度を60%以下,できれば50%以下に下げることが可能になる.
ARDS/ALIに対してはPEEPを中心とした人工呼吸管理が主流となっているが,ARDS/ALIの死亡率は依然として高いままであった.最近になり,その理由として人工呼吸により肺に陽圧をかけ肺を無理に伸展させることが肺組織を傷害する危険性が指摘された.そこで通常の1回換気量の設定より低く(10 mL/kg以下)換気量を設定して人工呼吸を行うとARDS患者の予後が改善することが明らかとなった.低換気量で人工呼吸を行う結果,PaCO2は上昇し,pHは低下するが,ある程度のPaCO2の上昇は認める(permissive hypercapnia)治療法である.この呼吸管理法がARDS/ALIに対して従来の方法よりすぐれているとの報告が相次ぎ現在では主流になりつつある.
(4)Ⅱ型呼吸不全の治療
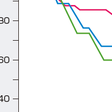
Ⅱ型呼吸不全では肺胞低換気によりPaCO2が上昇し,その結果低酸素血症が惹起される.したがって,治療の目標は肺胞低換気を是正することであり,その結果として低酸素血症を改善することである.前述の肺胞気式から,PaCO2が上昇すればPaO2が低下することが明らかであり,したがって,治療の主体はPaCO2 を低下させることである.まず原疾患に対する治療を十分に行い,換気を改善させる必要がある.それにもかかわらずPaCO2が上昇し,pHが低下してアシデミア(酸血症)に陥ったときには,最終的に気管内挿管・人工呼吸の適応となる.気管内挿管・人工呼吸の導入は生体への大きな侵襲となるため,その適応には慎重さが必要であるが,pH<7.2では絶対的な適応であり,pH<7.20〜7.25は相対的適応である.人工呼吸では通常,鎮静・麻酔下に気管内挿管を行なうため,生体への侵襲が大きく,種々の合併症が生ずる可能性がある.そのため,最近では意識下に鼻マスクやフェイスマスクを用いて気道を確保し人工呼吸を導入する非侵襲的陽圧呼吸(non-invasive positive airway pressure:NPPV)が注目され繁用されるようになってきている(図3-1-31).通常の挿管・人工呼吸療法は侵襲的人工呼吸とよばれ,いわば呼吸管理における最後の手段的方法である.
人工呼吸の換気様式には調節換気としてvolume control ventilation(VCV)とpressure control ventilation(PCV)があり,部分的補助換気としてsynchronized intermittent mandatory ventilation(SIMV)とpressure support ventilation(PSV)がある.自発呼吸がない場合には調節換気から換気を開始し,自発呼吸がある場合にはSIMVやPSVなどの部分的補助換気から開始するのが望ましい.自発呼吸を残すことのメリットは非常に大きいため,調節換気はできるだけ避けるべきである.
(5)CO2ナルコーシス
CO2ナルコーシス(CO2 narcosis)とはPaCO2の上昇によりアシデミアが増悪し,昏睡状態が出現する病態で,Ⅱ型呼吸不全例では最も重篤な病態である.慢性呼吸不全の急性増悪は臨床上,よく遭遇する例であるが,特に慢性閉塞性肺疾患(COPD)患者の急性増悪時に不用意に酸素を投与した場合に出現することが多い.進行したCOPD患者はしばしば慢性的にⅡ型呼吸不全を呈しているが,感染などを契機として呼吸不全が悪化すると低酸素血症が増悪する.このとき,高濃度あるいは高流量の酸素を投与すると換気が抑制され急激にPaCO2が上昇する.CO2の上昇に対して腎臓の代償が間に合わなければアシデミアが出現し,pH<7.2では昏睡が出現する.これを改善させるためには気管内挿管・人工呼吸が必要となる.後述するNPPVが奏効することもあるが,原則的には侵襲的人工呼吸の適応である.
しかし,CO2ナルコーシスを恐れるあまり低酸素状態を放置してはならない.低酸素血症は,より直接的に生命の危機に直結するため,低酸素状態の患者に対しては必ず酸素療法を併用しなくてはならない.Ⅱ型呼吸不全患者に対する酸素療法は,高濃度や高流量の酸素投与を避け,24〜28%の低濃度酸素投与から開始すべきである.ハイフローシステムの酸素投与が不可能ならば,鼻カヌラで0.5〜1.0 L/分の低流量の酸素から開始しPaCO2が急速に上昇せずPaO2が60 mmHg以上になるように酸素投与を調節していく必要がある.Ⅱ型呼吸不全の酸素療法では,このcontrolled oxygen therapyを原則とした方が安全である.
(6)NPPV
近年,気管内挿管をせず,その代わりに鼻マスクやフェイスマスクにより気道を確保し,人工呼吸を行う呼吸管理が普及しつつある.この方法の普及には閉塞型睡眠時無呼吸症候群に対するnasal continuous positive airway pressure (CPAP)療法の開発・発展の影響が大きい.nasal CPAP治療においては鼻マスクの装着が必須であるため,操作性にすぐれ患者にフィットした鼻マスクやフェイスマスクが開発された.これらの鼻マスクやフェイスマスクの開発・改良により気管内挿管に匹敵する気道確保が可能となり,現在では,気管内挿管を行う前にまず考慮すべき呼吸管理法となっている.意識状態が比較的よく協力的な患者で,痰を自力で排泄できることが条件で,通常はバイレベル型の圧型人工呼吸器を用いて人工呼吸管理を行う.最近ではNPPVに特化した専用人工呼吸器が開発され,マスクの開発・改良と相まって種々の呼吸不全例に適応が広がっている.
適応としては,①COPDの急性増悪,②気管支喘息の重積発作,③肺結核後遺症の急性増悪,④間質性肺炎,⑤心原性肺水腫,⑥胸郭損傷,などがあげられるが,このうち有効性が確立されているのは,COPDの急性増悪と心原性肺水腫である.これらの呼吸不全では,気管内挿管の前に可能であれば,まずNPPVを試行すべきであろう.NPPVは,気管内挿管を回避し自発呼吸を温存するため患者にとってのメリットはきわめて大きいが,医療者側にとっては負担の大きい呼吸管理法といえる.NPPVを開始後のしばらくは患者の呼吸・循環動態が安定するまでベッドサイドで患者を観察する必要があり,人工呼吸の条件の設定にも時間がかかることが多い.しかし,侵襲的呼吸管理に比べれば患者にとってはるかに負担が小さく,今後は人工呼吸管理の主役となる可能性を秘めている治療法と考えられる.[赤柴恒人]
■文献
日本呼吸器学会ARDSガイドライン作成委員会編:ALI/ARDS診療のためのガイドライン,秀潤社,東京,2005.日本呼吸器学会NPPVガイドライン作成委員会編:NPPV(非侵襲的陽圧換気療法)ガイドライン.南江堂,東京,2006.
Shapiro BA, et al eds: Clinical Application of Respiratory Care, 3rd ed, Year Book Medical Publisher, Chicago, 1985.
出典 内科学 第10版内科学 第10版について 情報