翻訳|hemoglobin
精選版 日本国語大辞典 「ヘモグロビン」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「ヘモグロビン」の意味・わかりやすい解説
ヘモグロビン
へもぐろびん
hemoglobin
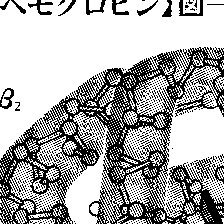
脊椎(せきつい)動物の赤血球中に多量に存在し、酸素を運搬する色素タンパク質で、血色素ともいい、Hbと略記される。鉄を含むポルフィリン環(ヘム)とタンパク質の一種(グロビン)、すなわちプロトヘム約4%(そのうち鉄9%、プロトポルフィリン91%)とグロビン約96%からなる。この鉄原子には酸素と可逆的に結合する能力があり、生体内では酸素運搬の役割を果たしている。ヘモグロビン1分子は4個のポリペプチド鎖からなり、それぞれのポリペプチド鎖には一つずつのヘムが含まれている。したがって、ヘモグロビン1分子には鉄原子が4個含まれ、鉄原子1個につき1分子ずつ酸素が結合する。ヘモグロビンは酸素圧の高い肺やえらで酸素を結合し、酸素圧の低い組織に達すると酸素を遊離する。ヘモグロビン分子の酸素飽和度を縦軸に、酸素の分圧を横軸にとると、S字型の酸素解離曲線を示す。これは酸素のヘモグロビンへの結合に協同性があるためで、アロステリック効果とよばれる。また、酸素の放出は水素イオン濃度(pH)が下がることによって促進されるので、炭酸ガスが多くてpHの低い末梢(まっしょう)の組織では、より酸素を遊離しやすくなっている。その炭酸ガスは血漿(けっしょう)中に溶けて肺に運ばれ、肺呼吸で体外に放出されるとpHはふたたび元に戻り、ヘモグロビンは酸素と結合するようになる。炭酸ガス分圧の増加やpHの低下により酸素とヘモグロビンの親和性が低下するのはボーア効果とよばれる。一方、筋肉中にはヘモグロビンとよく似た色素タンパク質であるミオグロビンがあり、ヘモグロビンよりも酸素との親和力が大きく、比較的酸素圧の低いところでもヘモグロビンから酸素を受け取って筋肉活動に供給している。なお、ヘモグロビンは1グラム当り1.36ミリリットルの酸素を結合するが、一酸化炭素の親和力は酸素に比べ200倍以上もあり、一酸化炭素の濃度が大であれば酸素を駆逐して酸素不足をもたらし、一酸化炭素中毒をおこす。
[若木高善]
ヘモグロビンの研究
ヘモグロビンは大きな結晶をつくるのでX線回折による研究が早く進み、イギリスのケンドルーらによって1960~1962年に一次、二次、三次、四次構造が確定された。また、ポリペプチド鎖のアミノ酸配列はヒトをはじめ、サル、ウシ、ウマ、ブタなどのヘモグロビンですでに決定されており、各種の動物にわたって共通した部分が多く、それらはヘモグロビンの活性維持にとくに重要な部分とみられ、種によって異なる部分は、進化過程に関連するものとして注目されている。さらに、立体構造と機能との関係なども明らかにされている。
[若木高善]
構造と変異株
ヒトのヘモグロビンは正常成人の場合、グロビン分子は141個のアミノ酸からなるα(アルファ)鎖2本と、146個のアミノ酸からなるβ(ベータ)鎖2本が互いに寄り添った形で四量体(4個の単量体が結び付いて1分子となった会合体)を形成している。ところが、胎児のヘモグロビンは胎内環境に有利なように、α鎖二つと、β鎖とは若干異なるγ(ガンマ)鎖とよばれる部分二つとからなる。成人の場合をヘモグロビンA、胎児の場合をヘモグロビンFとよぶ。このヘモグロビンFは出生後数日のうちにヘモグロビンAに変わるため、ヘモグロビンの合成と分解が一度におこって黄疸(おうだん)に似た症状を呈する。このようなヘモグロビンのつくりかえは、オタマジャクシがカエルに変態するときにもみられる。また、ヘモグロビンAにもいくつかの変異株(正常な遺伝子にDNAの塩基の変異を生じた個体)が知られている。たとえば、アフリカ中央部の黒人にみられる鎌(かま)形赤血球貧血症(異常血色素症)患者のヘモグロビンは、β鎖のN末端から6番目のグルタミン酸がバリンになっているだけで酸素結合能力が低く、貧血症をおこしやすくなっている。これはヘモグロビンS症ともよばれる。鎌形赤血球内ではマラリア原虫の成育が阻害されるので、この貧血症はマラリア耐性となる。このほか、β鎖のN末端から26番目のグルタミン酸がリジンに置換されたヘモグロビンE症などもあり、ヘモグロビンの機能が不十分であったり、異常であったりするものが数多く知られ、すでに世界中で250種類余の異常ヘモグロビンが発見、登録されている。このなかには、前記のような1個ないしは数個のアミノ酸の違いによるものが多く、かつ遺伝するので、原因は、遺伝子であるDNA(デオキシリボ核酸)中の数個の塩基の差によると考えられている。アメリカのポーリングは、これらのヘモグロビン異常症を分子病とよんでいる。
[若木高善]
合成
ヘモグロビンの合成は骨髄の赤芽球細胞で行われ、哺乳(ほにゅう)類の場合、成熟赤血球は核を放出してしまうため、もはやヘモグロビンは合成されなくなっている。ヘムはグリシンと酢酸だけから合成され、その後に鉄を取り込み、通常のタンパク合成でつくられたグロビンと結合してヘモグロビンになる。赤血球が崩壊するとヘモグロビンは肝臓で分解され、ポルフィリン環は胆汁色素となって排出される。なお、ヘモグロビンの寿命は約120日である。
[若木高善]
『ノーマン・マクリーン著、山上健次郎訳『ヘモグロビン』(1981・朝倉書店)』▽『斉藤正行ほか編『生化学実習』(1987・講談社)』▽『永井清保編著『基本血液病学』(1987・世界保健通信社)』▽『日本生化学会編『続 生化学実験講座第8巻 血液(上)』(1987・東京化学同人)』▽『Archie A. MacKinney, Jr. 著、柴田昭監訳『血液の病態生理』(1989・西村書店)』▽『山根至二著『楽しく学ぶ健康読本』(1990・三洋出版貿易)』▽『諏訪邦夫著『酸素はからだになぜ大切か――いつも酸素は不足している!』(1990・講談社)』▽『新版日本血液学全書刊行委員会編『新版 日本血液学全書・別巻 分子血液学』(1990・丸善)』▽『マックス・ペルツ著、林利彦・今村保忠訳『生命の第二の秘密――タンパク質の協同現象とアロステリック制御の分子機構』(1991・マグロウヒル出版)』▽『水上茂樹著『赤血球の生化学』(1993・東京大学出版会)』▽『マックス・ペルツ著、黒田玲子訳『タンパク質――立体構造と医療への応用』(1995・東京化学同人)』▽『中村隆雄・山本泰望編『分子生理学ノート』(1995・学会出版センター)』▽『John D. Hawkins著、田宮信雄・田宮徹訳『遺伝子の構造と発現』(1995・東京化学同人)』▽『有坂文雄著『スタンダード 生化学』(1996・裳華房)』▽『Robert K. Murrayほか著、上代淑人監訳『ハーパー・生化学』(1997・丸善)』▽『奥田拓道ほか編『病気を理解するための生理学・生化学』(1998・金芳堂)』▽『国立療養所東京病院看護部編著『呼吸器疾患看護ケア・マニュアル』(1999・文光堂)』▽『松田一郎監修、新川詔夫ほか編『医科遺伝学』(1999・南江堂)』▽『H・R・マシューズほか著、藤本大三郎・井上晃監訳『マシューズ生化学要論』(2000・東京化学同人)』▽『原野昭雄著『日本人の異常ヘモグロビン症』(2000・自然科学社)』▽『杉崎紀子著『身体のからくり事典』(2001・朝倉書店)』
改訂新版 世界大百科事典 「ヘモグロビン」の意味・わかりやすい解説
ヘモグロビン
h(a)emoglobin
血液中の酸素を運搬する赤色色素タンパク質。血色素ともいう。Hbと略される。魚類から哺乳類にいたる脊椎動物に広く分布し,血液の赤血球中に存在する。ヒトの血液は1ml中に約5×109個の赤血球を含み,1個の赤血球中には約2.8×108個のヘモグロビンが含まれている。環形動物などの非脊椎動物にも存在するが,血球中ではなく血漿(けつしよう)に直接溶けている。ヒトでは骨髄の赤血球細胞でつくられて,約120日間体内を循環する。
ヘモグロビンは分子量約6万4500で,4個のサブユニットから成る。各2本ずつのαとβペプチド鎖である。各サブユニットは1個のヘムグループをもち,そのヘム鉄に酸素分子が結合して肺から各組織へ運搬される。酸素が結合する際,4個のヘムには相互作用が働き,結合は順を追って容易になる。つまり,1個酸素がつくと,すぐに他の三つのヘムも酸素を結合するようになる。逆に1個離脱すると,残りの酸素も離脱しやすくなる。その結果,酸素吸着曲線はS字形になり,肺で十分に酸素を結合し,組織で容易に離脱させることが可能になる。また,溶液が酸性になると酸素を離脱しやすくなる(ボーア効果)。活動中の筋肉は多量の酸素を消費するが,その結果,血液が酸性になるので,より能率よく酸素が供給される。そのほか,組織の代謝産物である二酸化炭素と結合して,それを肺まで運搬するという重要な生理機能もある。ヘモグロビン分子の化学構造や生合成に遺伝的な異常があると,サラセミアなどの溶血性貧血を生じることが多い。
タンパク質としてはヘモグロビンが最初に結晶化され(1849,ライヘルトK.B.Reichert),最初に生理学的な目的が明らかにされ(1864,ストークスG.Stokes),ミオグロビンとともにX線回折によってその三次構造が最初に明らかにされた。そして,多くの生物種や突然変異種ヘモグロビンの膨大なアミノ酸配列データと原子レベルでの詳しい構造研究から,タンパク質の重要な性質,すなわち活性機能,アミノ酸配列と立体構造の関係,アロステリック効果,突然変異と機能の関係などが明らかにされている。
執筆者:宝谷 紘一
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「ヘモグロビン」の意味・わかりやすい解説
ヘモグロビン
→関連項目血液|人工赤血球|赤血球|ヘム|ヘモシアニン|ポルフィリン|ミオグロビン|溶血
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「ヘモグロビン」の解説
ヘモグロビン
ヘモグロビン
hemoglobin
血色素ともいう.ヘムタンパク質の一種.Hbと略記される.おもに脊椎動物の赤血球中に含まれるが,ある種の無脊椎動物,微生物にも存在し,酸素分子を運搬する役割を果たす.ヘムはプロトヘムであり,鉄イオンは二価の状態で酸素と可逆的に結合する.脊椎動物のヘモグロビンは分子量6~7×104,4個のサブユニットからなり,それらのうち2個ずつは互いに等しく,α鎖,β鎖と名づけられている.α鎖,β鎖はともに1本のポリペプチド鎖と1分子のヘムよりなる.酸素分子はヘムと1:1で結合し,Hb 1分子は4分子の酸素と結合する.酸素との結合に際してヘムは互いに独立ではなく,1分子のヘムが酸素化されると残りのヘムは酸素との親和性が増加する.この現象をヘム間相互作用という.また,Hbの酸素親和性は pH によっても変化し,pH 6.5~7.5では pH の減少とともに親和性は減少する.これはボーア効果と称される.生体内では,ヘム間相互作用,ボーア効果によって pH が高く,酸素分圧の高い肺,エラと,二酸化炭素,乳酸などの代謝産物により pH が低く酸素分圧の低い組織との間で効率よく酸素を運搬しうる.これらのほかに,Hbの酸素親和性は赤血球中の2,3-ジホスホグリセリン酸,イノシトールヘキサリン酸などによっても制御されている.これに対し,無脊椎動物のヘモグロビンはヘム間相互作用,ボーア効果はなく,原始的な脊椎動物であるヤツメウナギなどの円口類ではそれらの中間的な性質を示す.Hbは典型的なアロステリックタンパク質([別用語参照]アロステリック酵素)であり,一次構造の決定をはじめ,X線結晶解折による詳細な立体構造が解明されており,研究がもっとも進んでいるタンパク質の一つである.

出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「ヘモグロビン」の意味・わかりやすい解説
ヘモグロビン
hemoglobin
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「ヘモグロビン」の解説
ヘモグロビン
世界大百科事典(旧版)内のヘモグロビンの言及
【アロステリック効果】より
…(1)基質と異なる化合物による酵素活性の調節,(2)特定のリガンドによるタンパク質の高次構造変化を介した機能の調節,(3)協同性によるタンパク質の機能の調節(図1,図2)。 (2)と(3)の典型的な例は,ヘモグロビンにみられる。4個のサブユニットから成るヘモグロビンに酸素分子が順次結合していくと,サブユニットの四次構造(空間配置)が変化し,また酸素濃度に対する酸素吸着度はS字性を示す。…
【血液】より
…(2)血液の色 〈赤き血潮〉といわれるように,血液は特有な赤い色調をもっている。これは赤血球の中に含まれているヘモグロビン(血色素)という鉄Fe原子をもった色素タンパク質によるものである。動脈血は大部分のヘモグロビンに酸素が結合して鮮紅色を呈するが,静脈血は酸素を結合していないヘモグロビンを含むので暗赤色である。…
【血球】より
…
[血球の機能]
赤血球,白血球,血小板はそれぞれ独立した働きをして,生命の維持に欠かせない役割をはたしている。(1)赤血球 おもな機能は酸素の運搬で,これは赤血球の中に含まれているヘモグロビン(血色素)の働きによる。1gのヘモグロビンは最高1.39mlの酸素を結合することができる。…
【呼吸色素】より
…多くは血液中にあって血液色素ともよばれ,酸素を運搬あるいは貯蔵する役割を果たしている。ヘモグロビンはほとんどすべての脊椎動物と一部の無脊椎動物に,クロロクルオリンはケヤリなどに,ヘムエリトリンはホシムシやシャミセンガイにみられ,いずれも鉄を含んでいる。銅を含むヘモシアニンは甲殻類や頭足類にみられる。…
【タンパク質(蛋白質)】より
…その一つは酵素のフィードバック阻害で,代謝の最終産物が代謝系の始めの方の酵素に結合して活性を阻害し,むだな産物の生産を防ぐ役割を果たしている。また,アロステリック効果はヘモグロビンによる酸素運搬にも使われている。ヘモグロビンは1分子当り4分子の酸素を結合するが,一つめの酸素分子を結合するとアロステリック効果で他の結合部位へと影響が及び,二つめ以降の酸素結合がより容易になる。…
【鉄】より
…鉄を含むタンパク質は総称して鉄タンパク質と呼ばれるが,ヘム基(ポルフィリン環に鉄が配位したもの)をもつものと,ヘム基をもたず,SH基を介して鉄と結合しているものの2種がある。前者はヘムタンパク質と呼ばれ,動物赤血球中のヘモグロビン,筋肉中のミオグロビンなどがその例で,おのおの4分子,1分子のヘム基をもち,酸素分子の運搬,貯蔵の役割をしている。後者には,光合成の際,電子伝達の役割を果たすフェレドキシンなどがあるが,総称して鉄硫黄タンパク質と呼ばれる。…
【貧血】より
…一般に貧血といえば,〈立ちくらみ〉など起立性低血圧症による,いわゆる脳貧血(失神)をさすことが多いが,医学的には,血液中のヘモグロビン濃度が低くなった状態をいう。また,身体の一部分に血がなくなることも貧血ということがあるが,この場合は,ふつう虚血といって区別される。…
※「ヘモグロビン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...