化学辞典 第2版 「平衡電極電位」の解説
平衡電極電位
ヘイコウデンキョクデンイ
equilibrium electrode potential
単純電極において,電極-溶液界面で起こる電極反応が電気化学的平衡状態にあるときの電極電位.単に平衡電位,または可逆電極電位ともいう.電極反応を一般に次式
νAA + νBB + …  νXX + νYY + … + ne
νXX + νYY + … + ne
で表すと,それに対応する平衡電極電位 Erev は次のように与えられる.
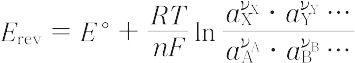
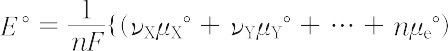
-(νAμA° + νBμB° + …)}
ここで,νは化学量論係数,nは電極反応に関与する電子数,aは活量,μ°は標準化学ポテンシャル,Rは気体定数,Tは絶対温度,Fはファラデー定数である.上式は一般に平衡電極電位に対するネルンストの式とよばれる.E °は電極反応に関与する物質がすべて標準状態にあるときの平衡電極電位であり,標準電極電位とよばれる.一般に,電極電位は実測不可能な量であるので,平衡電極電位もその絶対値を測定することはできない.したがって,問題の単純電極系をある一定の基準電極と組み合わせてガルバニ電池を構成し,この電池の平衡電圧をもって平衡電極電位の値とする.一連の電極系に対して,組み合わせる基準電極をつねに同じものとすれば,この値は各電極系の平衡電極電位の相対値を示すことになり,この意味でこの値を相対平衡電極電位という.実際に相対平衡電極電位を十分厳密に決定できるのは,構成したガルバニ電池内に液-液界面が含まれない場合のみであり,含まれるときには,液-液界面に生じる液間電位を適当な方法で補正しなければならない.基準電極として標準水素電極を用いたときの値を水素電極尺度の値といい,国際規約により普通この値が用いられる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

