化学辞典 第2版 「リン酸製造法」の解説
リン酸製造法
リンサンセイゾウホウ
manufacture of phosphoric acid
リン酸の製造法は,乾式法,湿式法の二つに大別できる.【Ⅰ】(1)乾式法:電気炉や高炉でリン鉱石をけい石やけい砂とともに無煙炭で還元し,気体状のリンをつくり,これを空気または加熱水蒸気で酸化してP2O5として,水に溶解してリン酸を製造する方法.反応は複雑であるが,最終的には次式のようになる.
Ca3(PO4)2 + 3SiO2 + 5C →
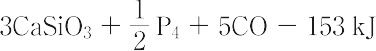
乾式法には,次の五つの特徴がある.
(ⅰ)鉄分,アルミナを多く含む低品位リン鉱石を処理できる.
(ⅱ)リンの気化と酸化とを別々に行うことができる.
(ⅲ)高純度,高濃度(85% H3PO4まで)リン酸が得られる.
(ⅳ)硫酸は不要であるが電力を要し,生産費用は割高である.
(ⅴ)スラグはセメント原料となる.
電気炉法のHV一段法工程を次に示す.まず,リン鉱石を塊状とし,コークスとけい砂とともに炉に入れる.温度は約1300 ℃ でスラグは炉の上から定時的に取り出す.リン鉄は下の穴から取り出し,鉄鋼の脱酸剤とする.リンとCOを含むガスは除じんして空気とまぜる.リンを燃やしP2O5とし,冷却,水和してリン酸にする.水和器から出るガスはミストコットレルで処理し,リン酸分を電気的に捕集する.原単位はP2O51 t に対し,リン鉱石(P2O530%)4.15 t.コークス(C 87%)0.78 t,けい砂(SiO296%)0.51 t,H2O720 t である.二段階法では氷を注加した2個の充填塔中でリンを濃縮させ,これを精製し,純リン酸を直接つくる.
(2)湿式法:リン鉱石を硫酸分解してリン酸を製造する方法.その反応は次式のようになる.
Ca5F(PO4)3 + 5H2SO4 + 10H2O →
3H3PO4 + 5CaSO4・2H2O + HF
副生セッコウの組成により,二水塩法,半水塩法,無水塩法に大別できるが,二水塩法が広く行われている.リン酸液中でのセッコウ組成はリン酸濃度と反応温度に支配される.乾式法に比べて純度が低く,おもに肥料用とする.【Ⅱ】リン酸の濃縮:湿式法で合成したリン酸の濃度はP2O530~33% であるが,高濃度リン酸肥料用などでは38~55% に濃縮する.次の四つの濃縮法がある.
(1)液中燃焼法:液中燃焼バーナーで燃料を燃焼させ,発生する熱を直接リン酸液に伝える方法.
(2)フラッシュ蒸発法:リン酸液を熱交換器で68~69 ℃ に予熱し,二段式スチームエジェクターにより,90 kPa 程度の真空にした蒸発缶で濃縮する方法.
(3)噴霧蒸発法:塔頂からP2O530~33% リン酸を噴霧し,下方から重油燃焼ガスで吹き上げ,向流接触で濃縮する方法.
(4)ロングチューブ蒸発法:長管中に通したリン酸外部から蒸気加熱して濃縮する方法.【Ⅲ】リン酸の精製:日本において湿式法リン酸を溶媒抽出法で精製する方法が検討され,高純度リン酸を高収率で製造することが可能となっている.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

