精選版 日本国語大辞典 「硫酸」の意味・読み・例文・類語
りゅう‐さんリウ‥【硫酸】
- 〘 名詞 〙 ( [オランダ語] zwavelzuur の訳語 ) 無機酸の一種。化学式 H2SO4 無色で粘り気のある重い液体。硝酸に次いで酸性が強い。水を吸収しやすいため水溶液を煮つめただけでは純度九八・三パーセント以上のものは得られないばかりでなく、有機物からも水の組成と同じ割合で酸素と水素を奪いとり、炭素を遊離させる。製法には鉛室法・接触法などがあり、硫黄またはその化合物を酸化させ、水に吸収させて作る。脱水剤・酸化剤・乾燥剤などとして用いられ、硫安・火薬・染料・無機化学薬品の製造、有機化合物の合成、石油や油脂の精製など、工業上の用途はきわめて広い。
- [初出の実例]「硫酸を剖解すれば分れて硫黄と酸素の二物となる」(出典:遠西医方名物考補遺(1834)七)
硫酸の語誌
→「たんさん(炭酸)」の語誌
日本大百科全書(ニッポニカ) 「硫酸」の意味・わかりやすい解説
硫酸
りゅうさん
sulfuric acid
化学式H2SO4、式量98.1。組成H2SO4の純物質あるいはその水溶液をいうが、普通は水溶液をさすことが多い。工業上もっとも重要な強酸の一つ。通常、水溶液濃度が90%以上のものを濃硫酸といい、90%未満の濃度のものを希硫酸といっている。現在、日本で生産されている硫酸はほとんどが接触法(後述)によって合成されたもので、原料とする二酸化硫黄の不純物を十分に除去してから(触媒の保護のため)触媒上で空気酸化を行う。そのため得られるものはきわめて純度が高いものであり、市販品は濃度96%、密度1.84g/cm3、18mol/dm3のものが普通である。濃硫酸にさらに三酸化硫黄(いおう)を溶かしたものが発煙硫酸である。
[守永健一・中原勝儼]
歴史
硫黄やミョウバンは古くから知られていたから、硫酸もなんらかの形で用いられたかもしれないが、その製法が歴史に初めて登場したのは8世紀ごろで、アラビア人ゲーベル(ジャービル・ビン・ハイヤーン)がミョウバンを乾留してつくったと伝えられている。15世紀ごろ硫黄を硝石とともに燃やして三酸化硫黄が得られることがわかり、18世紀にはイギリスで、ガラス器を用いてこの混合物を燃焼、器内で硫酸を製造する工場がつくられた。その後、ガラスのかわりに鉛室が用いられ、硫黄の燃焼炉が鉛室から分離された。19世紀になると改良が進み、硫黄のかわりに安価な硫化鉄鉱が用いられるようになり、ゲイ・リュサック塔で窒素酸化物が回収され(1827)、グラバー塔で回収含硝硫酸(酸化窒素を含む硫酸)の脱硝が行われるようになり(1859)、鉛室式硫酸製造法の基本ができあがった。さらに、鉛室を用いない、いわゆる塔式製造法へと発展し(1909)、硝酸式製造法が完成した。しかし、これらの方法は現在では接触式にとってかわられており、行われていない。1831年、白金石綿を触媒として二酸化硫黄と酸素から三酸化硫黄を生成することがみつけられたが、不純物により白金の触媒能が失われやすいため工業化は遅れた。その後、精製した二酸化硫黄を用いてイギリスで工業化に成功し(1881)、染料工業の発展とともに20世紀の初めごろ大規模な工業化が進んだ。1924年バナジウム触媒が発明され、白金に比べて安価、毒作用を受けにくい利点のため急速に発達し、現在ではバナジウム触媒を用いる接触式硫酸製造法が主流となっており、硝酸式製造法はすべて行われなくなっている。日本では1872年(明治5)金銀地金の製錬に必要なため大阪造幣寮で鉛室式が採用され、接触式は1905年(明治38)平塚火薬製造所で初めて用いられた。
[守永健一・中原勝儼]
製造法
三酸化硫黄を水に溶かすと硫酸が得られる。三酸化硫黄の製造は、実験室的には硫酸鉄(Ⅲ)水和物、発煙硫酸、二硫酸ナトリウムなどを加熱分解する方法が用いられる。
工業的硫酸製造法は、硫黄、硫化鉱などを燃焼させて二酸化硫黄を発生させ、一種の触媒として酸化窒素の気体を混ぜ、酸化反応をおこして硫酸を得る硝酸式製造法と、十分に精製・乾燥した二酸化硫黄を400℃以上に加熱して、酸化バナジウム(Ⅴ)などの触媒による接触酸化を行って得た三酸化硫黄から硫酸をつくる接触式製造法とに大別される。いずれの方法においても二酸化硫黄の製造までは共通である。
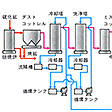
二酸化硫黄の発生には、焙焼(ばいしょう)炉を用いて硫黄、硫化鉄鉱を過剰の空気中で焙焼する。焙焼炉には硫黄炉、流動焙焼炉など、いろいろな形式がある。また、製錬廃ガス(銅、亜鉛、鉛などの製錬に際して発生する鉱石の焙焼炉ガス)も、二酸化硫黄の濃度は比較的低いが量が多く煙害問題をおこすので、その利用法が研究され、硫酸製造の原料として使われている。焙焼炉から出るガス中には、鉱塵(こうじん)やヒ素、セレンなどの含有量の高い鉱石ではこれらの酸化物が昇華して混入するおそれがある。とくに接触式では原料ガスの精製が必要であり、冷却、洗浄、電気集塵装置などを用いて精製が行われる。接触式硫酸製造工程についてはを参照されたい。
[守永健一・中原勝儼]
硝酸式硫酸製造法
以前は、グラバー塔とゲイ・リュサック塔の間に数個の鉛室を配置した鉛室式が行われたが、現在では鉛室を用いない塔式製造法のペターゼン塔式がわずかに操業されているだけである。生成した硫酸水素ニトロシルが加水分解されて、亜硝酸と硫酸を生成する。実際の反応では、二酸化硫黄の酸化反応の大部分は硫酸水素ニトロシル中で進むものと考えられている。硝酸式硫酸製造の反応についてはを参照されたい。得られる硫酸は濃度が低い(80%以下)ため、肥料の製造用などに使われる。
接触式硫酸製造法は、硝酸式に比べて純度や濃度が高く、精製硫酸や発煙硫酸の製造に適している。焙焼炉ガス中に含まれる不純物は、触媒の効果を弱め寿命を短くするので、とくにガスの精製に重点を置き、除塵したガスを冷却して希硫酸で洗浄し、濃硫酸で乾燥したのち転化器に導き、酸化バナジウム(Ⅴ)(V2O5-K2SO4-SiO2系)触媒により酸化反応をおこさせる。二酸化硫黄はほとんど完全に三酸化硫黄に酸化される。
2SO2+O2―→2SO3
三酸化硫黄を直接に水に吸収させると、水蒸気に触れて硫酸の霧を生じ、三酸化硫黄の回収が困難となる。硫酸は濃度98.3%で蒸気圧が最低となるので、三酸化硫黄を98%硫酸に吸収させて発煙硫酸や100%硫酸をつくり、これをガス吸収塔からの希硫酸や水で濃度を調節し、一部を製品とし、一部は循環させて三酸化硫黄の吸収用に用いる。
[守永健一・中原勝儼]
性質
純硫酸は無色、粘性のある油状液体である。少量の水が加わると比重はかえって増加するが、多量の水が加わるとしだいに減少する(硫酸の比重変化についてはを参照されたい)。多くの無機・有機物を溶かし、熱すれば290℃で分解し始め、三酸化硫黄SO3を発生する。98.3%硫酸は共沸混合物で最高沸点338℃を示す。濃硫酸を水と混ぜると多量の熱を発生する。発生熱は硫酸の濃度が増すにつれて大きくなり、1キログラム当りの発熱量は61.25%のとき39キロカロリー、純硫酸では193キロカロリー、100%三酸化硫黄で486キロカロリーである。水との間に一水和物(無色、融点8.6℃、沸点290℃)や二水和物(無色、融点-39℃、沸点167℃)などの水和物をつくる。硫酸の状態図(融点)についてはを参照されたい。
硫酸は水と激しく結合するだけでなく、種々の化合物中の水素原子と酸素原子をH2Oの割合で奪う、いわゆる脱水作用がある。多くの有機物はこの作用により炭素を遊離する。たとえば、砂糖などの炭水化物に濃硫酸を注ぐと激しく発熱して分解し、炭素のみを残す。また、吸湿性が強いので、デシケーターに入れて乾燥剤として用いられる。硫酸は二塩基酸で、水溶液は二段階に電離して強酸性を示す。
H2SO4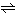 H++HSO4-
H++HSO4-
HSO4-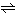 H++SO42-
H++SO42-
希薄溶液で第一段の電離は完全に進行するが、第二段の電離定数は0.02(18℃)である。電離度は1規定で51%、0.1規定で59%であり、酸としては塩酸、硝酸よりやや弱い。希硫酸は亜鉛、鉄などと反応して水素を発生するが、銅、銀などとは反応しない。濃硫酸は酸化作用があり、とくに熱濃硫酸は希硫酸に溶けない金属(金、白金以外)のほか、炭素、硫黄を酸化する。濃硫酸や発煙硫酸は有機物と反応してスルホン酸をつくり、濃硝酸との混合物(混酸)は有機化合物のニトロ化に使われる。鉄と鉛に対する作用は特異的である。鉄は濃硫酸により不溶性の皮膜をつくって内部が保護される(不動態)ので、輸送用タンクに用いられる。一方、鉛は希硫酸(75%以下)に不溶だが濃硫酸に溶け、とくに温度が高いほどその傾向が強い。硫酸塩には正塩M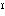 2SO4と酸性塩M
2SO4と酸性塩M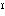 HSO4がある。硫酸塩の多くは水に溶けるが、アルカリ土類金属の硫酸塩や鉛塩などは難溶性である。
HSO4がある。硫酸塩の多くは水に溶けるが、アルカリ土類金属の硫酸塩や鉛塩などは難溶性である。
[守永健一・中原勝儼]
用途
硫酸の消費量は、従来一国の化学工業水準のバロメーターといわれるほどで、その用途は広く、硫酸に関係のない製品はないといってもいいすぎではない。日本では2013年に100%換算で約638万トン製造されている。また、硫酸の国内需要は肥料16%、繊維11%、無機薬品27%、その他46%となっている(2013)。
その用途は次のように分類される。
(1)硫酸を直接の原料として用い、製品中に硫酸分を含むもの 硫酸アンモニウム、過リン酸石灰、ナトリウムやカリウムなどの金属の硫酸塩、ミョウバン、硫酸ジメチル。
(2)硫酸の化学反応性を利用するが、製品中に硫酸分を含まないもの 湿式リン酸、塩酸、酢酸、銅などの金属製錬、フェノール、ナイロンやビニロンなどの合成繊維、各種の染料および中間物。
(3)酸化助剤用 アルデヒド、キノン、有機硫化物など。
(4)還元助剤用 水素の発生。
(5)ニトロ化助剤用 ニトロベンゼン、ニトロセルロース、TNTその他の火薬。
(6)脱水性の利用 アルコールからのエーテル製造、ガス乾燥。
(7)酸性の応用 ハロゲンなどの製造。
(8)侵食性の応用 鉄・黄銅・青銅・銀のさび落とし。
(9)触媒 酢酸エステルなど各種エステルの製造。
(10)精製または洗浄用 石油精製、油脂の洗浄。
(11)その他 蓄電池用、殺菌剤、殺虫剤、防腐剤、化学分析試薬。
濃硫酸は強い脱水作用および腐食作用があるので、皮膚や衣類に付着しないよう注意する。付着したときは大量の水または希アンモニア水で洗う。希硫酸でも衣類に付着したものを放置しておくとぼろぼろになる。蒸気としての人体に対する許容濃度は1mg/m3。
[守永健一・中原勝儼]
改訂新版 世界大百科事典 「硫酸」の意味・わかりやすい解説
硫酸 (りゅうさん)
sulfuric acid
化学式H2SO4。硫黄のオキソ酸の一つ。化学工業および関連産業における基本素材の一つとして広範な需要をもつ。硫酸の生産量,消費量,消費形態は,その国の化学工業の水準や体質を表すとされている。硫酸の製造は古く錬金術で見いだされていた。無機鉱酸の一つである硫酸は種々の金属やその化合物を溶解する力がきわめて大きく,金を他の金属から分離するのに用いられたためである。すでに8世紀にはアラビアの錬金術師ジャービル・ブン・ハイヤーンがミョウバンあるいは緑バンを乾留してつくったという記録が残っている。15世紀ころには硫黄を燃焼させて得られる二酸化硫黄SO2を硝石KNO3によって三酸化硫黄SO3とし,これを水に溶かして硫酸を得ていたといわれる。この方法は現在の硝酸法の原理と変りないが,釣鐘形のガラス器を用いて生産されていた。硫酸が大規模に工業生産されるようになったのは18世紀に入ってからである。1746年にイギリスのバーミンガムに鉛室式による工場が設立された。18~19世紀には硫酸はガラスの原料である炭酸ナトリウムを合成するルブラン法ソーダ工業の主原料としての需要が大きかった。その後,硫酸を使わないソーダ工業の発達によって使用量は一時減少したが,硫安や過リン酸石灰などの肥料,人絹,石油工業などへの用途が開かれた。20世紀になると空中窒素の固定によってアンモニアおよび硝酸が製造されるようになり,硫酸の需要は減少をみるが,新たに繊維,医薬,農業,顔料,金属,石油化学工業などでの需要の増加により今日の大規模な硫酸工業に至っている。
性質
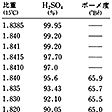
純粋な硫酸は無色の粘り気のある液体。融点10.36℃,比重1.83(18℃)。熱すると290℃でSO3を発生して分解しはじめる。濃硫酸はJIS規格によって95.0%以上と規定されているが,市販のものは96%,比重1.84,濃度35.9規定のものがふつうである。
濃硫酸は水の蒸気圧がきわめて低く,また吸湿性を示すため,乾燥剤,脱水剤として用いられる。化学の実験室ではデシケーター中に置いて各種水溶液の濃縮あるいは化学物質の乾燥などによく用いられる。乾燥剤としての濃硫酸は水の吸収容量の大きいことが特色である。水とは任意の割合で混合する。水和熱が大きいので(-⊿H=8.8kcal/mol)濃硫酸を水に溶解して希硫酸とする場合は硫酸はごく少量ずつよくかくはん(攪拌)しながら加えていかないと,水溶液が部分的に過熱状態となって突沸するので危険である。水溶液の比重を表1に示す。水溶液の凝固点は比重1.20の硫酸で-28℃,1.40のもので-37℃である。いわゆる純粋な硫酸といわれるものは正確には多くの化学種の平衡混合物であり,次の平衡があると考えられる。
2H2SO4⇄H2S2O7+H2O
H2SO4+H2O⇄H3O⁺+HSO4⁻
H2SO4+H2S2O7⇄H3SO4⁺+HS2O7⁻
2H2SO4⇄H3SO4⁺+HSO4⁻
最後の式に示す自己解離の平衡は大きく左に偏っている。濃硫酸に三酸化硫黄を溶かし込んだものは発煙硫酸と呼ばれ,当モルの混合物とした場合の主成分は二硫酸H2S2O7である。硫酸は強い二塩基酸であり希硫酸(希水溶液)中では第1段の解離はほとんど完全であり第2段の解離定数はK2=2×10⁻2(18℃)である。
H2SO4⇄H⁺+HSO4⁻
HSO4⁻⇄H⁺+SO42⁻
希硫酸と金属との反応は一般にイオン化系列の水素よりも上位のものは水素を発生して溶解し硫酸塩を生ずる。熱濃硫酸の場合はH2SO4─→SO3+H2Oに解離し,このSO3による酸化力があるので銅や水銀などイオン化系列で水素より下位のものであっても二酸化硫黄SO2を発生して溶解し硫酸塩とする。ただし,金および白金族元素は反応しない。鉄は希硫酸には溶けるが濃硫酸ではその酸化力によって表面に酸化膜の不動態がつくられ,かえって侵されない。このため濃硫酸の輸送には鉄製の容器を用いる。一般に,金属の酸化物,水酸化物,炭酸塩は硫酸に溶解し硫酸塩となる。また,塩化物,硝酸塩も過剰の硫酸と加熱すると,それぞれHCl,NO2を発生して分解し硫酸塩に変化する。硫酸イオンSO42⁻,硫酸水素イオンHSO4⁻を含む塩には,硫酸塩MⅠ2SO4,MⅡSO4,硫酸水素塩MⅠHSO4をはじめタットン塩MⅠ2MⅡ(SO4)2・6H2Oやミョウバン類MⅠMⅢ(SO4)2・12H2Oなど多くの複塩が知られている。KAl(SO4)2・12H2Oは単にミョウバンと呼ばれることがあり,焼ミョウバンはこれを脱水したもので,KAl(SO4)2の組成をもつ。硫酸塩は一般に安定な結晶であって結晶水をもつものが多い。バリウム塩,ストロンチウム塩,鉛(Ⅱ)塩,カルシウム塩が水に難溶であるほかは可溶性である。硫酸塩泉に含まれるのはCaSO4,Na2SO4,MgSO4である。硫酸イオンSO42⁻は正四面体形でありS-Oは1.50Å。硫酸は多くの有機物と反応してスルホン化,脱水,エステル化などを行う。希硫酸で紙などに字を書いて熱すると,その部分の硫酸濃度が高くなり脱水作用で紙を炭化し黒変する。希硫酸は強酸なので取扱いに注意を要し,濃硫酸は強い脱水作用があるので,皮膚や衣服についた場合は多量の水で十分にすすぐ。
執筆者:漆山 秋雄
工業的製法
製造プロセスは前述のように〈原料→SO2→SO3→H2SO4〉である。すなわち,(1)二酸化硫黄の製造,(2)二酸化硫黄の酸化,(3)三酸化硫黄から硫酸液の製造,の3過程に分けられ,このうち(2)が中核をなす。酸化方式には硝酸法と接触式とがあるが,前者は鉛室式および塔式・半塔式に,後者はバナジウム系触媒を用いる方法およびそれ以外の触媒を用いる方法に分けられる。鉛室式,塔式,接触式でつくられる各硫酸を,それぞれ鉛室硫酸,塔式硫酸,接触硫酸と呼ぶ。硫酸の工業生産は1746年イギリスのローバックJ.Roebackにより鉛室が開発されたのが始まりである。19世紀中ごろゲイ・リュサック塔,グラバー塔が発明され,鉛室式硫酸製造工程が確立した。日本では1872年にイギリス人により大阪造幣寮で小規模の鉛室が建造された。一方,接触式は時期的には新しく,最初は白金触媒が試験されたが(1831),後に五酸化バナジウム触媒が開発され(ドイツ,1924),実用的なため唯一の硫酸触媒となっている。日本では,1933年ころバナジウム触媒が輸入された。接触式では高濃度・高純度硫酸液が得られるため,採用する工場が多くなり,日本でも硝酸法プラントはごくわずかになった。日本における硫酸の生産量は約700万tであるが,肥料工場が激減しており,金属製錬所が増加している。これは,原料形態の変転を物語るものである。
(1)原料 明治期には単体硫黄,硫黄鉱であったが,その後は硫化鉄鉱の主流時代が長く続いた。しかし近年は表2に示すように金属製錬排ガスからのSO2利用が1位に置き換わった。銅,鉛,亜鉛,ニッケル等の硫化鉱物がこれらの金属の原料であり,乾式製錬時に分解発生するSO2ガスを硫酸原料に振り向ける。また単体硫黄も増加している。そのほか排煙脱硫ガスを硫酸原料とする方式もある。
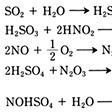
(2)反応と工程 (a)硝酸法は要約すると次の反応で表される。
SO2+NO+NO2+H2O─→H2SO4+2NO
反応の途中にニトロシル硫酸NOHSO4(硫酸水素ニトロシルHSO4・NO)が生成し,これが次式のように分解する。
NOHSO4+H2O─→HNO2+H2SO4
鉛室式はグラバー塔(酸化窒素ガスを放出する装置)とゲイ・リュサック塔(酸化窒素ガスを吸収する装置)との間に数個の鉛室(鉛張りの部屋)を置く。鉛室の上から水を降らせて下部に鉛室硫酸を得る。塔式は鉛室を設けずに数基の塔のみから成る。
(b)接触式は次の反応による。
SO2+1/2O2─→SO3
触媒はV2O5・K2SO4混合物(K2SO4は助触媒)をケイ藻土担体にしみ込ませた粒状製品である。耐久性大,被毒作用小で,転化率が95%以上を示す。反応機構の要点は次式のようである。
2V5⁺+SO2+O2⁻⇄2V4⁺+SO3
2V4⁺+1/2O2─→2V5⁺+O2⁻
反応は400~500℃で進行する。実際の操業温度では触媒は融液状で作用すると説明されている。1段接触式を改良したものに2段接触式があり,転化率がさらに上昇する。
用途
硫酸の化学作用を利用した広範な用途がある。酸分解反応は硫酸塩製造用,スルホン化反応用,置換分解反応用などに用いられる。そのほか,酸化剤,脱水剤,乾燥剤,精製用,洗浄用など,それぞれの目的に対応した多くの分野での用途がある。日本における1980年の硫酸消費全量は673万5842t(100%H2SO4)で,その品種別の消費量は,肥料用32.6%,無機薬品24.4%,繊維工業11.7%がおもなもので,そのほか紙・パルプ,有機薬品工業,製錬用などとされる(1995年の内需は656万tで,内訳は化学肥料を除く化学工業34.0%,化学肥料17.5%,化学繊維9.0%,金属7.8%などである)。
執筆者:金澤 孝文
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「硫酸」の意味・わかりやすい解説
硫酸【りゅうさん】
→関連項目酸性雨|ハステロイ
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「硫酸」の解説
硫酸
リュウサン
sulfuric acid
H2SO4(98.08).水溶液濃度が90% 以上のものを濃硫酸といい,それ以下の濃度のものを希硫酸という.二酸化硫黄から無水硫酸をつくり,水と反応させて濃硫酸をつくる.市販の濃硫酸は,通常96% 水溶液で,密度1.84 g cm-3,17.95 mol L-1 である.純硫酸は粘ちゅうな液体.融点10.5 ℃.密度1.834 g cm-3.ほとんどの金属を溶かす.水には多量の熱を発して溶け,自由に混和する.水溶液では強酸となるが,二塩基酸としての第二電離定数Ka2 は2×10-2 で,比較的小さい値を示す.濃硫酸は脱水作用があり,熱すると強い酸化作用を示す.有機化合物と脱水,酸化,スルホン化などの反応を行う.工業的に大規模に生産され,有機反応助剤,硫安,リン酸肥料,薬品,化学繊維,金属精錬,紙・パルプなどの製造に用いられている.腐食性で皮膚,粘膜をおかす.有毒.[CAS 7664-93-9][別用語参照]硝酸式硫酸製造法,接触式硫酸製造法
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「硫酸」の意味・わかりやすい解説
硫酸
りゅうさん
sulfuric acid
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「硫酸」の解説
硫酸
世界大百科事典(旧版)内の硫酸の言及
【化学工業】より
…
[第1期 酸・アルカリ工業の成立]
1760年代に始まるイギリスの産業革命によって繊維工業が急成長したため,18世紀後半には漂白工程の能率向上と漂白剤の安定入手が求められた。繊維の漂白は,それまで,海藻や木炭などの灰汁に浸し,天日にさらし,それから酸敗ミルクで中和するという方法であったが,この時代にはソーダと硫酸が使われるようになった。硫酸は,1749年にイギリスのJ.ローバックが硫黄を原料として鉛室を用いる方法(鉛室法)で大量につくることに成功し,また91年にはフランスのN.ルブランがルブラン法によるソーダの工業化に成功した(ソーダ工業)。…
※「硫酸」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
1 花の咲くのを知らせる風。初春から初夏にかけて吹く風をいう。2 ⇒二十四番花信風...