内科学 第10版 の解説
免疫・炎症に関与する細胞・分子(リウマチ性疾患総論)
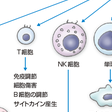
免疫システムは,自然免疫(非獲得免疫,innate immunity)と適応免疫(獲得免疫,adaptive immunity)の2つに分けられる.自然免疫は最初の防衛にあたり,細菌やウイルスなどの多くの病原体は感染が成立する前に排除される.この防衛システムが突破された場合,適応免疫が発動する.自然免疫は感染を繰り返しても抵抗力が高まることはないが,適応免疫は病原体に対して特異的な反応を示し,免疫学的記憶により,同じ病原体に暴露されるたびに強くなる.免疫システムを構成するほとんどの細胞は,多分化能をもつ造血幹細胞から分化する(図10-1-1).自然免疫をつかさどる細胞は,おもに貪食能をもつ細胞で,多形核白血球や単球,単球から分化するマクロファージ,さらにはナチュラルキラー細胞(NK細胞)などがあり,また可溶性の因子としては,補体,リゾチーム,肺炎球菌のC蛋白に結合し補体を活性化するC反応性蛋白(CRP),インターフェロン(IFN),種々のサイトカインやケモカインがある.これらの液性因子の多くは炎症性メディエーターとしての機能もあわせもつ.一方,適応免疫をつかさどる細胞は,おもにリンパ球(T細胞やB細胞)である.また,適応免疫にかかわる可溶性因子は抗体である.自然免疫と適応免疫の2つの免疫システムも独立して働いているのではなく,両者の間には多くの相互作用がある. 通常,炎症は一過性であり組織の修復により鎮静化する.しかし,何らかの原因で病原微生物の排除が行われず持続感染が生じた場合や物理的刺激が持続する場合,あるいは免疫反応の調節異常が生じたり,自己抗原を異物と誤認して自己免疫反応を生じたりすると炎症性メディエーターの産生が持続し,炎症性メディエーターは免疫担当細胞のさらなる活性化を促すという悪循環を形成し炎症の慢性化が生じる.
(1)多形核白血球(多核白血球)
分葉した核と多くの顆粒をもつ細胞で顆粒球ともよばれ,自然免疫において中心的な役割をなす.Giemsa染色による顆粒の染色性により,好中球(neutrophil),好酸球(eosinophil),好塩基球(basophil)に分類される.
a.好中球
末梢血中の多形核白血球の90%以上を占めており,寿命は2~3日と短く,常時骨髄でつくられている.細胞質内に中性色素で染まるアズール顆粒など小顆粒をもつ.強い遊走能と貪食能を有し,活性化補体成分(C5a)や線溶系の産物,ほかの白血球,血小板,細菌成分により走化性が高まり,感染局所に集まる.細菌などの微生物を貪食すると,ファゴソームとよばれる小胞内に取り込む.この小胞は,ミエロペルオキシダーゼとムラミダーゼ(リゾチーム)など酵素を豊富に含んだ顆粒(ライソゾーム)と融合し,その酵素により殺菌・分解する.好中球の表面には免疫グロブリンのFcに対する受容体があり,IgGが結合すると貪食能が亢進し,また,顆粒を放出する.これはⅢ型アレルギーにも関与する.
b.好酸球
好酸球は貪食機能をもつが,末梢血白血球の2~5%とわずかで,実際には傷害作用を有する顆粒を放出することで防御能を示す.この好酸性の細胞内顆粒は,おもに主塩基性蛋白(major basic protein:MBP),陽イオン蛋白(eosinophil cationic protein:ECP),ペルオキシダーゼ(eosinophil peroxidase:EPO),好酸球性神経毒(eosinophil-derived neurotoxin:EDN)の4つの蛋白質を含んでいる.これらは寄生虫に対する傷害作用を示し,MBP,ECP,EPOは原生動物と蠕虫類に対して細胞毒性を有する.
好酸球はヒスタミナーゼなど炎症を抑える物質ももつ.ヒスタミナーゼはヒスタミンを分解しアレルギー反応を緩和するとともにプロスタグランジンを放出することで,好塩基球の脱顆粒を抑制する.アリルスルファターゼは好塩基球から分泌されたロイコトリエンを中和する.
一方,好酸球はI型アレルギーにおける遅発型反応にかかわっており,MBP,ECP,EPOはマスト細胞からのヒスタミン放出を誘導したり,気道上皮細胞を障害することにより気道過敏症を亢進させたりすることも明らかになった.
c.好塩基球とマスト細胞(肥満細胞)
好塩基球は末梢血白血球の2%以下で濃い紫の顆粒をもつ.マスト細胞も類似の性質をもつ.この顆粒にはヒスタミン,ロイコトリエン,血小板活性化因子,セロトニン,ヘパリンなどの物質が含まれている.好塩基球とマスト細胞の細胞表面にはIgEのFcに対する受容体であるFcε受容体が発現しており,血中のIgEが結合する.このIgEに対応する抗原(アレルゲン)が結合し架橋されると,前述の顆粒が放出(脱顆粒)され,顆粒に含まれるヒスタミンなどの炎症性メディエーターは,血管の透過性亢進,血流の増加,炎症細胞の遊走,平滑筋の収縮などを引き起こし,花粉症や気管支喘息あるいはアナフィラキシーの症状が出る(I型アレルギー,即時型アレルギー).
(2)単核食細胞
単球やマクロファージはリンパ球よりも大型の細胞で,丸かあるいは軽いくびれをもつ核を有し,単核食細胞とよばれる.これらの細胞も骨髄の幹細胞から分化する.単球は血管内から種々の臓器や組織に移行しマクロファージとなる.また,肝のKupffer細胞,腎糸球体メサンギウム細胞,脳のミクログリアも単核食細胞に分類される. これらの細胞の機能は大きく2つに分かれる.第1は貪食そのもので,第2は抗原提示細胞としての機能である.
a.貪食細胞としての単核食細胞
貪食性マクロファージは,肝のKupffer細胞,腎糸球体メサンギウム細胞,脳のミクログリアとともに網内系細胞ともよばれる.細胞内にはライソゾーム顆粒を豊富に有し,そのなかには加水分解酵素やペルオキシダーゼが含まれており,微生物の分解に重要な役割を果たしている.マクロファージは糖鎖の受容体を発現しており,糖鎖を有する細菌に結合し貪食する.また,マクロファージの細胞表面には3種類のFcγ受容体が発現しており,キラー活性の誘導,オプソニン効果(抗体の結合した細菌は,Fcγ受容体を介して捕食されやすくなる)などの出現にかかわる.また,補体成分であるC3bに対する受容体を発現しており,補体が結合した細菌に結合して貪食する.また,単球やマクロファージはT細胞由来のサイトカインにより活性化されるとともに,インターロイキン(IL)-1,IL-6,腫瘍壊死因子(TNF)などのサイトカインを産生し,T細胞の活性化や炎症反応の惹起にかかわっている.
b.抗原提示細胞としての単核食細胞
抗原提示細胞(antigen presenting cell:APC)は細胞膜表面に抗原断片のペプチドを結合して,ヘルパーT細胞に抗原を提示する.その際にT細胞受容体を介して抗原特異的なシグナルを伝えT細胞の活性化を引き起こす.また,同時に補助シグナル分子を介して,抗原非特異的な補助シグナルを伝えT細胞の反応を調節する.主要組織適合性抗原(major histocompatibility complex:MHC)のクラスⅡ分子(ヒトではヒト白血球抗原(human leukocyte antigen:HLA)-DR)を強く発現しているのが特徴である.APCは皮膚やリンパ節,脾臓,胸腺などさまざまな臓器に存在する.マクロファージは貪食した抗原をペプチドに分解し,MHCに乗せて抗原提示を行う.皮膚におけるAPCはLangerhans細胞で,皮膚から進入してきた抗原を細胞表面に結合し,リンパ管へ入り,リンパ節へと運んで抗原をT細胞に提示する.また,胸腺髄質内に存在する樹状細胞は,胸腺におけるT細胞の自己反応性T細胞クローンの選択にかかわっていると考えられる.リンパ節や脾臓には濾胞内樹状細胞(follicular dendritic cell:FDC)が存在する.FDCは食作用をもたず,リンパ節や脾臓のB細胞領域内の二次濾胞に存在し,B細胞に抗原提示を行う.このAPCはMHCのクラスⅡ分子を発現していないが,Fcγ受容体や補体の受容体CR1(CD35)分子を発現している.
(3)血小板
血小板は骨髄のミエロイド系の細胞から分化した骨髄巨核球からつくられる.止血機能が中心であるが,血小板にもMHCのクラスⅠ分子やFcγタイプⅡ受容体,凝固第Ⅷ因子に対する受容体などを発現しており免疫にかかわる.血管内皮細胞の傷害時に血小板が凝集すると,サイトカインや炎症性メディエーターを放出し,血管透過性の亢進や補体の活性化を引き起こす.
(4)リンパ球
リンパ球は適応免疫系を担う主役であり,抗原を特異的に認識する機能と免疫を記憶するという機能をもつ.リンパ球も造血幹細胞から分化する.リンパ球は大きくT細胞とB細胞に分けられるが,末梢血には,通常の小リンパ球に比べて核/細胞質比が小さい,大型顆粒リンパ球(large granular lymphocyte:LGL)とよばれる細胞が存在する.この細胞はアズール好性顆粒をもつ.抗原を特異的に認識するシステムはT細胞とB細胞が発現している抗原特異的受容体による.
a.T細胞
T細胞は抗原特異的なT細胞受容体(T cell receptor:TCR)を細胞表面に発現している.造血幹細胞から産生されたT細胞は,増殖と分化を繰り返し,胸腺において分化・成熟する.この過程でTCR遺伝子の再構成が生じ多様性を獲得するが,胸腺で2段階の選抜を受ける.
ⅰ)T細胞の多様性の獲得
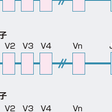
TCRの発現には抗体分子と同様に,遺伝子再構成が生じる.TCRはα鎖とβ鎖,あるいはγ鎖とδ鎖の2つのポリペプチドのヘテロダイマーからなり,それぞれの遺伝子はV,D,J,C領域とよばれる領域をもつ(ただし,α鎖,δ鎖にD領域はない).それぞれの領域は遺伝子断片の集合体で,αβ鎖を例にとると,ヒトではVαは86個,Jαは60~70個,ならびに1個のCα遺伝子から構成され,Vβは138個,Dβは2個,Jβは13個ならびに2個のCβ遺伝子から構成される(図10-1-2).これらのランダムな組み合わせによる多様性は約4×107で,これにN領域への遺伝子の挿入などの修飾が加わり多様性は1010にも及ぶ.
ⅱ)胸腺でのクローン選択
多様性を獲得したT細胞は,胸腺で2段階の選抜を受ける.まず自己のMHCを正確に認識できるTCRをもつクローンのみが生き残り(positive selection),次にMHC上に提示された自己抗原に反応したTCRをもつT細胞クローンがアポトーシスにより死滅する(negative selection).結果的に,自己反応性T細胞は除去され,自己抗原に対する免疫寛容が成立する.しかし,このようなクローン選択は完璧ではなく,生き残った自己反応性T細胞の機能は,末梢でさらに抑制されている.
ⅲ)T細胞の抗原認識におけるMHC拘束性
TCRはαβ鎖,あるいはγδ鎖からなるが,αβT細胞はさらに補助受容体の違いによりCD4 T細胞とCD8T細胞に分けられる.T細胞は,原則としてMHC分子と結合した抗原のみを認識できる.したがって,前述の抗原提示細胞(APC)が必要になる.APCは抗原を取り込み分解したペプチドをMHCに結合した形でT細胞に提示する.この際にT細胞は自己のMHC分子を同時に認識する.
MHCはAPC上に発現している糖蛋白分子で,クラスⅠ分子とクラスⅡ分子がある.MHCクラスⅠ分子はウイルスなどの細胞内に進入した抗原や自己抗原をCD8T細胞または細胞傷害性T細胞に提示する.MHCクラスⅡ分子はAPCによって貪食されペプチドに分解された抗原をCD4 T細胞に提示する.
また,T細胞による抗原認識には,TCRの補助受容体であるCD4またはCD8分子が必要である.CD4T細胞はCD4分子を介してMHCのクラスⅡ分子と結合し,おもにヘルパーT細胞として働く.CD8T細胞はCD8分子を介してMHCのクラスⅠ分子に結合し,おもに細胞傷害性T細胞として働く.
γδT細胞はCD4-CD8-のダブルネガティブT細胞とCD4-CD8+T細胞が存在するが,いずれも細胞傷害性T細胞として働く.
ⅳ)ヘルパーT細胞分化の制御
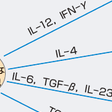
CD4T細胞は免疫システムを制御するうえで重要な役割をもつヘルパーT細胞としての機能を有する.ヘルパーT(Th)細胞は抗原刺激によりTh1細胞とTh2細胞に分化する(図10-1-3).Th細胞分化はサイトカインとよばれる生体内情報伝達分子により巧みに制御されている.ナイーブなTh細胞はIL-12の刺激を受けてTh1細胞に分化し,IL-4の刺激を受けるとTh2細胞に分化する.Th1細胞はIL-2やIFN-γ,TNFを産生するとともに,おもに細胞性免疫に関与する.自己抗原に対するTh1細胞の過剰な反応はある種の自己免疫疾患の発症にかかわっていると考えられている.一方,Th2細胞はIL-4,IL-5,IL-10,IL-13などを産生し,おもにB細胞の増殖・分化を促進し,抗体産生,すなわち液性免疫に関与する.Th2細胞の過剰な反応は,アレルギー反応と密接な関連がある.また,最近,Th1でもTh2細胞でもなく,IL-17を産生するヘルパーT細胞としてTh17細胞の存在が示され,自己免疫疾患や炎症性疾患の病態形成に重要な役割を果たしていることが,おもに疾患モデルマウスで示された.この細胞はIL-6やTNFなどの炎症性サイトカインも産生し,関節リウマチやCrohn病などの炎症性自己免疫疾患の発症にかかわると考えられるが,ヒトでの病理的意義についてはいまだ明らかではない.
一方,生体内にはこれらのT細胞の働きを抑制する抑制性T細胞(regulatory T cell:Treg)が存在し,自己免疫疾患の発症や炎症反応,アレルギー反応を制御していることが知られている.このTreg細胞は細胞表面にCD25(IL-2受容体α鎖)を発現しており,おもにFoxp3遺伝子が陽性の細胞として見いだされる.これらのT細胞の分化と制御のメカニズムは種々の免疫疾患の病態を知るうえで重要であり,今後さらなる検討が加えられると思われる.
b.B細胞
B細胞は膜結合型の免疫グロブリンを細胞表面に発現しており,この分子は抗原特異的な受容体(B cell receptor:BCR)として働いている.B細胞は,発生初期では肝臓で,その後は骨髄の造血幹細胞からつくられる.B細胞は抗原刺激を受けると,分裂・増殖してリンパ組織で二次濾胞を形成し,その後形質細胞に分化し抗体を産生するようになる.このようなB細胞の抗体産生細胞への分化にはヘルパーT細胞からの刺激が不可欠である.抗体のもつ特徴である多様性と特異性は,T細胞受容体に共通する特徴であり,その仕組みは遺伝子の再構成すなわち生体の遺伝情報が後天的に進化するという,免疫システムにしかみられない生命現象でもある.
ⅰ)抗体の種類
抗体すなわち免疫グロブリンは基本構造として,2本の相同な約50 kDaの重鎖(heavy chain:H鎖)と2本の相同な約25 kDa軽鎖(light chain:L鎖)がS-S結合で結ばれた二量体からなる.ヒトの免疫グロブリンには5つの異なったクラス,すなわちIgG,IgM,IgA,IgD,IgEがあり,各クラスにより性質が異なる.
1)IgG:
血清中に最も多くみられる免疫グロブリンで,約150 kDaの分子量をもつ.二次免疫応答の中心をなし,抗原との親和性は非常に高く,毒素中和活性をもつ唯一の免疫グロブリンでもある.また,胎盤を通過する唯一の免疫グロブリンである.
2)IgM:
免疫グロブリンの約10%を占める.IgMは五量体構造をとっており,分子量は約900 kDaである.感染の一次免疫応答で最初に産生される免疫グロブリンで,五量体構造により,抗原との総合的な結合力が高い.凝集反応や補体結合能を有する.
3)IgA:
血中では170 kDaの単量体であるが,唾液や乳汁などに分泌される分泌型IgAは400 kDaの二量体である.分泌型IgAは分泌成分を結合しており蛋白分解を受けにくい.初乳には大量に含まれており,新生児の感染防御に重要な役割を果たす.
4)IgD:
血清中の免疫グロブリンの1%以下であるが,末梢血を循環しているB細胞の細胞表面に発現している.IgDは抗原刺激を受けて抗体産生細胞へ分化する過程で消失する.IgDの機能は不明な点が多い.
5)IgE:
血清中にごく微量しか存在しないが,IgEのFc受容体であるFcε受容体を介して,マスト細胞(肥満細胞),好塩基球の表面に結合している.抗原(アレルゲン)によりIgEが架橋されるとこれらの細胞から脱顆粒が起こり,即時型のアレルギー反応を引き起こす.一方,IgEは寄生虫の免疫に関与していると考えられている.
ⅱ)抗体の生物活性
抗体の生物活性は,①補体系の活性化,②貪食細胞による食作用の亢進(オプソニン効果),③マスト細胞や好塩基球からの脱顆粒の誘発,④ウイルスや毒素の中和などがあり,前述のごとくIgGは胎盤を通過し,胎児の免疫に関与する.また,IgAは外分泌液へ分泌され粘膜免疫に重要である.
ⅲ)抗体の多様性の獲得
あらゆる外来抗原に対応できるように,生体には1010種類以上の特異性の異なる抗体が存在する.抗体の多様性は,B細胞が骨髄で分化する過程で生じる体細胞遺伝子組み換えによることが利根川らにより明らかにされた.
抗体のH鎖遺伝子は,可変領域(V領域)の大部分をコードするV遺伝子と,定常領域(C領域)をコードするC遺伝子が,DおよびJ遺伝子をはさんでVDJCの順に並んでいる.最初にD遺伝子とJ遺伝子が組み換えられ,DJとなり,次にV遺伝子がDJ遺伝子に組み換えられVDJが形成され,さらにC遺伝子が組み換えられVDJC遺伝子再構成が起こる.L鎖はVJCの遺伝子再構成が起こる.これらの組み合わせによる多様性に加え,Nヌクレオチドとよばれる塩基が挿入され,多様性が増す(図10-1-4). また,抗体には5種類のクラスが存在するが,V遺伝子はそのままでC領域遺伝子のみが置換され,クラススイッチが生じる.クラススイッチはサイトカインにより誘導される.
c.NK細胞
NK細胞は通常のリンパ球よりも大型で細胞質に顆粒をもつ大型顆粒リンパ球(large granular lymphocyte:LGL)である.末梢血リンパ球の約10%がNK細胞である.NK細胞は抗原の感作なしにウイルス感染細胞や腫瘍細胞を攻撃する.マクロファージが産生するIL-12によって活性化されると,細胞傷害能は増強されるとともにIFN-γを産生する.IFN-γはウイルスの増殖を抑える.また,NK細胞はFcγ受容体を発現しており,Fcγ受容体を介して,抗体が結合した標的細胞を攻撃する(antibody-dependent cell-mediated cytotoxicity:ADCC).
(5)炎症性メディエーターとその作用
炎症反応を調節する炎症性メディエーターの多くは,免疫システムを形成する細胞により産生されるが,それ以外に肝細胞や血管内皮細胞,炎症局所の組織を形成する細胞から産生される.これらの物質にはケミカルメディエーター,サイトカインやケモカインといった糖蛋白,蛋白分解酵素などが含まれるが,補体や抗体にも炎症を惹起する作用がある.おもな炎症性メディエーターの由来と作用を表10-1-1に示す.
サイトカイン,ケモカインといった抗原に非特異的な免疫システムの調節因子は,炎症反応を調節する作用をあわせもつ.それらの中にも炎症を惹起する炎症性物質と炎症を抑制する抗炎症性物質が存在する.通常はバランスが保たれているが,炎症性物質の過剰産生,あるいは抗炎症性物質の産生不足によるバランス異常が長期間にわたり持続すると,免疫担当細胞のさらなる増殖と分化を招くとともに,慢性炎症の病理像を形成することになる.
炎症性メディエーターの多くは液性因子であり,炎症局所にとどまらず血流にのって発熱や倦怠感,食欲低下などの炎症症状,あるいは炎症性貧血,CRPやフィブリノゲンなど急性期蛋白の増加,低アルブミン血症,高ガンマグロブリン血症,自己抗体の出現などを引き起こすことがある.[西本憲弘]
出典 内科学 第10版内科学 第10版について 情報