精選版 日本国語大辞典 「免疫グロブリン」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「免疫グロブリン」の意味・わかりやすい解説
免疫グロブリン
めんえきぐろぶりん
immunoglobulin
イムノグロブリンともいう。脊椎(せきつい)動物の血液や体液中にあって抗体としての機能と構造をもつタンパク質の総称で、Igと略記する。血清中のγ(ガンマ)-グロブリンは、ほとんどがIgである。その基本構造は分子量約2万3000のL鎖2本と約5万~7万のH鎖2本がジスルフィド架橋(S‐S架橋)により結合したもので、全体で約15~19万の分子量になる。H鎖の種類、γ、α(アルファ)、μ(ミュー)、δ(デルタ)、ε(イプシロン)により、それぞれIgG、IgA、IgM、IgD、IgEの5クラスに分けられる。IgGには四つのサブクラスがあり、IgAには二つのサブクラスがある。L鎖は各クラスにκ(カッパ)とλ(ラムダ)の2種がある。同じクラスに属するものでもL、H両鎖のアミノ末端から110番目まではアミノ酸配列が多様で、可変領域とよんでいる。これによって個々の抗原に対応して特異的に結合するための立体構造をもつ抗原結合部位がつくられる。分子の形はいわばY字形で、二つの上端が等価の抗原結合部位であるのに対し、下端(カルボキシ末端)側は抗原と結合した抗体が補体や細胞と結合するなどの生物活性を示す部位である。
IgGは、分子量約15万5000で血清中にもっとも多く、1リットル当り8~18グラム含まれており、すべてがなんらかの抗原に対応する抗体である。IgAは基本単位が分子量約17万で、分子量約50万の三量体をつくっている。外分泌液中にあって粘膜における感染の防御を担っている。IgMは分子量約18万の基本構造の五量体であり、IgDは分子量約17万2000である。IgEは分子量約19万~20万で糖の含有量が多く、アレルギー反応に関与する。ある抗原の刺激を受けた一つのリンパ球B細胞は分化して免疫グロブリンを分泌する形質細胞(抗体産生細胞)となり、この抗原に対応する抗体だけを合成する。骨髄腫(しゅ)はこのような形質細胞が腫瘍(しゅよう)化したもので、一つの抗原決定基に対応する均一な抗体をつくる。ある抗体産生細胞と骨髄腫細胞を細胞融合させ、増殖させることによってこの均一な抗体、モノクローナル抗体(単クローン性抗体)を大量につくることができる。
[野村晃司]
『畔柳武雄他編『免疫学叢書6 免疫グロブリン』(1970・医学書院)』▽『新版日本血液学全書刊行委員会編『日本血液学全書8 血漿蛋白と免疫グロブリン』(1981・丸善)』▽『山村雄一・岸本忠三編『岩波講座 免疫科学1 免疫学入門』(1986・岩波書店)』▽『橘武彦著『免疫学への招待』(1986・日本評論社)』▽『河西信彦・森洋樹編、田元浩一他著『入門 免疫学』(1989・講談社)』▽『Edwin L. Cooper著、西東利男監訳、倉茂達徳他訳『図解免疫学』(1990・西村書店)』▽『三浦謹一郎編『蛋白質の機能構造』(1990・丸善)』▽『M. J. Owen著、垣生園子他訳『免疫系の認識機構――分子レベルからみた二大レセプターの構造と認識』(1991・南江堂)』▽『マックス・ペルツ著、林利彦他訳『生命の第二の秘密――タンパク質の協同現象とアロステリック制御の分子機構』(1991・マグロウヒル出版)』▽『赤坂一之編『タンパク質研究の最前線』(1991・さんえい出版)』▽『寺田信国編著、佐藤紀朗著『わかりやすい免疫学』(1991・メディカルレビュー社)』▽『松本秀雄著『日本人は何処から来たか――血液型遺伝子から解く』(1992・日本放送出版協会)』▽『小室勝利編『免疫グロブリン療法』(1992・近代出版)』▽『日本生化学会編『新・生化学実験講座12 分子免疫学(3)抗原・抗体・補体』(1992・東京化学同人)』▽『奥村康著『免疫のはなし』(1993・東京図書)』▽『奥原英二著『一般生化学』(1993・南江堂)』▽『松橋直他編『最新臨床免疫学』(1994・講談社)』▽『菊地浩吉・菊地由里著『最新免疫学図説』(1995・メディカルカルチュア)』▽『菊地浩吉他編『Annual review――免疫(1995)』(1995・中外医学社)』▽『奥平博一・宮本昭正著『やさしいアレルギー・免疫学』(1998・日本医事新報社)』▽『磯部敬著『免疫異常と腫瘍の接点――モノクローナル免疫グロブリン症』(1998・医薬ジャーナル社)』▽『矢田純一編『臨床医のための免疫キーワード100』(1999・日本医事新報社)』▽『宮坂信之他編『新版 臨床免疫学』(2001・講談社)』
改訂新版 世界大百科事典 「免疫グロブリン」の意味・わかりやすい解説
免疫グロブリン (めんえきグロブリン)
immunoglobulin
抗体タンパク質の総称。血清のタンパク質は電気泳動によりアルブミンとα-,β-,γ-グロブリンに分画されるが,抗体はほとんどがγ-グロブリン画分に見いだされ,また,γ-グロブリン画分のタンパク質の大部分は抗体であることから,抗体タンパク質は古くからγ-グロブリンと呼ばれていた。1960年代に,抗体には部分的に構造の異なるクラスやサブクラスとよばれるいくつもの種類があるが,すべての抗体タンパク質は類似した基本構造をもつことが明らかとなり,これを免疫グロブリンと総称することになった。
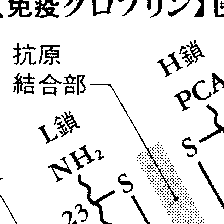
免疫グロブリン分子は,分子量約2万3000のL鎖と,分子量約5万のH鎖の2種のポリペプチド鎖から構成されている。図1のように,L鎖はH鎖のアミノ末端側半分と対をなして結合し,このようなH・Lペアがもう1組のH・LペアとH鎖のカルボキシル末端側で結合して分子を構築している。したがって免疫グロブリンの分子量は約15万である。2組のH・LペアはH鎖のほぼ中央部で図1のようにS-S結合によって結ばれていて,この部分はヒンジ部とよばれる。
L鎖はアミノ酸残基約二百十数個からなり,H鎖は約450個からなるので,アミノ末端から約110個ずつ区切ると,L鎖は二つの区域,H鎖は(ヒンジ部は除く)四つの区域に区切られる。抗体が抗原を結合する結合部位は,H鎖とL鎖が対をなしている部分(抗原結合フラグメント,Fab,図1,3参照)の先端にあり,両鎖の第1の区域,つまりアミノ末端から約110個ずつのアミノ酸によって構築されている。多数の免疫グロブリンのH鎖,L鎖のアミノ酸配列が比較された結果,この部分のアミノ酸配列は,異なった抗原に対する抗体分子ごとに部分的に異なっていることがわかったので,この部分は可変部variable regionとよばれる。可変部のアミノ酸配列の変化によって,抗体分子の結合部位の大きさ,形,深さ等に変化が生じるので,多種類の抗原に対してそれぞれ結合できる抗体分子がつくり出されるのである。
H鎖もL鎖も可変部以外のアミノ酸配列は一定しているので,定常部constant regionとよばれる。ただし,定常部は1種類ではなく,L鎖についてはκ,λの2種類,H鎖についてはμ,γ,α,ε,δの5種類がある。
免疫グロブリンはH鎖の種類により,図2のように,IgM,IgG,IgA,IgE,IgD(Igはimmunoglobulinの略)の5クラスに分かれ,IgGにはさらにγ鎖間の細かな差異によって四つのサブクラス,IgAにも二つのサブクラスがある。各クラスの免疫グロブリン分子には,L鎖としてκ鎖を含むものと,λ鎖を含むものの二つの型がある。一般に最も多量に産生されるのはIgGクラスであり,図1に示されているのはIgGの構造である。各種のクラスは進化によって生じたもので,IgMが最初に出現したと考えられている。現存の動物でも軟骨魚類のサメにはIgM様のクラスのみが見いだされるが,両生類,鳥類と進むにつれてIgGその他のクラスが出現する。
L鎖の可変部(VL)と定常部(CL),H鎖(γ鎖)の可変部(VH)と定常部の三つの区域(Cγ1,Cγ2,Cγ3)はアミノ酸配列にある程度の類似性があり,実際に免疫グロブリン分子内では図3のように各区域が比較的に類似した円筒状の折りたたみ構造領域(ドメイン)を形成して数珠状に連なり,Cγ2以外は向き合ったドメインどうしが結合している。
クラスによってH鎖の定常部の構造は少しずつ異なっているが,おおまかにみれば類似しており,いずれのクラスも上記のようなドメイン構造をしている。ただ,図2に記してあるように,IgMは,(μ・L)2という構成のサブユニットが5個重合して五量体をなしているので,分子量が他のクラスの約5倍となっている。またμ鎖とε鎖は,いずれも他のクラスのH鎖に比べてアミノ酸残基約110個分長い。このためにμ鎖とε鎖には1個ずつ余分のドメインがある。
免疫グロブリンのH鎖のカルボキシル末端側半分からなるFc部分(結晶性フラグメント,図3参照)は,抗体の生物活性,たとえば補体系の活性化,食細胞への結合による食作用促進,アレルギー反応の誘発等に必要な部分で,免疫グロブリンが胎盤を通過して母から胎児へ移行できるかどうかにも関係している。この部分の構造はクラスによって少しずつ異なるので,免疫グロブリンの生物活性はクラスごとに異なっている(〈抗体〉の項参照)。
免疫グロブリン分子が以上のように,種々の抗原を結合するのに必要な部分としては分子ごとに変化する可変部を有し,抗体として共通な生物活性を現すのに必要な部分としては各クラス内の分子間で一定した定常部を有することは,抗体分子としての働きを現すのにみごとに適合している。これは他のタンパク質にはみられない構造上の特性である。このようなユニークな分子がつくり出されるのは,可変部と定常部をコードする遺伝子が本来別々のもので,染色体上の離れた位置にあり,多数の可変部遺伝子の任意の一つが定常部遺伝子と接合して完全な1本のペプチド鎖の遺伝子として表現される仕組みだからである。
→免疫
執筆者:尾上 薫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「免疫グロブリン」の意味・わかりやすい解説
免疫グロブリン【めんえきグロブリン】
→関連項目アレルギー・マーチ|アレルゲン|帯状疱疹
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「免疫グロブリン」の意味・わかりやすい解説
免疫グロブリン
めんえきグロブリン
immunoglobulin
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「免疫グロブリン」の解説
免疫グロブリン
化学辞典 第2版 「免疫グロブリン」の解説
免疫グロブリン
メンエキグロブリン
immunoglobulin
[同義異語]イムノグロブリン
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
世界大百科事典(旧版)内の免疫グロブリンの言及
【アトピー】より
…25年にはコカ自身によって,アトピー罹患患者の血清中に,皮膚反応によって証明される抗体様物質が高率に存在することが明らかにされ,コカはこの物質をアトピー性レアギンatopic reaginと名づけた。このアトピー性レアギンの本態は,66年石坂公成らにより,特異な生物活性をもった免疫グロブリン(IgE)に属する抗体であることが証明された。体外から侵入した抗原物質(アレルゲン)に対してIgE抗体が産生される状況は,個人個人によって異なり,遺伝傾向が強い。…
【アレルギー】より
…かつては即時型と遅延型に2に大別されていたが,最近では以下のようにI型からIV型に分けられるようになった。(1)I型のアレルギー反応 アナフィラキシー型反応ないし免疫グロブリン中のIg E(immunoglobulin Eの略)と関係が深いことからIg E依存型反応とも呼ばれている。(2)II型のアレルギー反応 細胞,組織の破壊ないし融解をもたらす反応。…
【形質細胞】より
…機能的には,抗体を合成・分泌する抗体産生細胞の大半を占め,抗体産生細胞と同義に用いられることもある。形質細胞の細胞質は,無数のリボソームを外面に付着した粗面小胞体で埋められ,その中に抗体すなわち免疫グロブリンを入れている。このリボソームにより,細胞質は好塩基性色素で濃染される。…
【血液】より
…炎症は感染などの外からの刺激に対抗して生体内に生ずる防御反応であり,血液中に存在する抗体,補体,白血球の協同作用により行われる。抗体は,リンパ球が分泌する免疫グロブリンで,再感染を防ぐのに役だつ。補体は,単独または抗体と結合して活性化されたものが細菌などに結合して,これを融解させる作用がある。…
【抗原認識】より
…B細胞とT細胞では抗原受容体が同じではなく,抗原認識の仕組みも異なることが知られている。B細胞の受容体は,本質的には抗体タンパク質(免疫グロブリン)と同一の分子であり,これに抗原が結合することがB細胞活性化の引金となる。T細胞の抗原受容体は抗体分子とは異なるものであるが,抗体分子の場合と似た遺伝子組換えの仕組みによってT細胞が未熟な前駆細胞から分化してくる間に細胞ごとに異なる抗原特異性をもった受容体が細胞表面に出現する。…
【抗体】より
…B細胞が抗体産生細胞の前駆細胞であって,抗原で刺激されると,通常T細胞の補助効果を受けながら増殖,分化して抗体を合成,分泌するようになる。
【抗体の分子構造と種類】
[抗体の構造]
抗体タンパク質にはいくつもの種類があって免疫グロブリンと総称されるが,免疫グロブリンはすべて共通の基本構造を有する。抗体タンパク質は大小2種のポリペプチド鎖,すなわちH鎖(heavy chain,分子量約5万)とL鎖(light chain,分子量約2万3000)からなる。…
※「免疫グロブリン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...