内科学 第10版 の解説
分子標的治療薬の作用機序と有効性(造血器腫瘍の発症機構と治療)
分子標的治療薬とは,特定の分子を標的として開発された医薬品であり,癌薬物療法においては“古典的な抗癌薬”と区別する意味合いがある.“古典的な抗癌薬”とは細胞毒性を有する抗癌薬を意味し,核酸や細胞周期にかかわる分子群を治療標的としていることがわかっている.言い換えると,分子標的治療薬は開発コンセプトや創薬の段階から分子レベルの標的を定めている点が特徴である.
分類
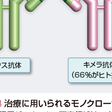
実用化されている分子標的治療薬には,モノクローナル抗体(monoclonal antibody)と低分子化合物(small molecule)の2種類がある.モノクローナル抗体の臨床開発は1980年代から始まり大きな期待が寄せられた.しかし当初使用されたマウスモノクローナル抗体での臨床効果は不十分であった上,免疫原性によるショックなども出現した.90年代に入り遺伝子組換え技術によって,マウス-ヒトキメラ抗体あるいはヒト化抗体が作製され(図14-7-3),リツキシマブなどが大きな成功をおさめた.最近ではヒト型モノクローナル抗体や,抗体にラジオアイソトープ標識あるいは抗癌薬を結合させて殺傷能力を高めた抗体医薬も登場している.抗体療法に共通する特徴として,標的分子への特異性がきわめて高く,体内における血中濃度や代謝は予測可能であることがあげられる.さらに,既存薬との交叉耐性はなく抗癌薬との併用可能であることがメリットであるが,細胞内分子を標的にできないことや,製造コストなどが問題である.
一方,癌の分子病態に基づき,受容体・シグナル伝達,血管新生,プロテアソーム蛋白分解系,転写・エピゲノム制御などにかかわる分子を,低分子化合物を用いて阻害する薬剤開発も進んでいる.慢性骨髄性白血病(chronic myeloid leukemia:CML)におけるイマチニブ治療は,「癌蛋白質」BCR-ABLを標的としており,治療コンセプトのみならず臨床エビデンスまでも実証された最初の低分子化合物である.このような,腫瘍細胞が依存している分子への標的療法のみならず,腫瘍に特異的ではないが増殖・生存あるいは進展などに関与する分子群も標的とされている.
開発当初は分化誘導薬あるいは抗癌薬として発見されたが,その後の研究によって分子標的薬と見なされている場合もある.急性前骨髄球性白血病におけるPML-RARαを標的としたオールトランス型レチノイン酸(all-trans retinoic acid:ATRA)療法,ヒストン脱アセチル化酵素阻害薬やDNAメチル化阻害薬がこれに属する.標的分子をピンポイントで抑制し,正常細胞に対する影響が少ないという当初のイメージは,マルチキナーゼ阻害薬や細胞周期関連蛋白質への標的薬の出現,あるいは標的薬による副作用の認識によって変わりつつある.
分子標的治療薬
a.抗体
1)リツキシマブ:
マウスのヒトCD20に対する抗体のFabとヒトFcのキメラモノクローナル抗体である(図14-7-3).CD20は正常・腫瘍を問わず,B前駆細胞~成熟B細胞にかけて細胞膜表面に発現するが,B前駆細胞以前あるいは,形質細胞にはみられない.リツキシマブが標的細胞を殺傷するメカニズムとして,抗体依存性細胞介在性細胞傷害(antibody-dependent cellular cytotoxicity:ADCC),補体依存的細胞傷害(complement-dependent cellular cytotoxicity:CDC)があげられ,抗体によるアポトーシス誘導効果も報告されている.わが国では2001年に低悪性度または濾胞性B細胞性非Hodgkinリンパ腫,マントル細胞リンパ腫を対象として承認され,現在ではCD20陽性のB細胞性非Hodgkinリンパ腫に適応が拡大している.リツキシマブ投与時にinfusion reaction(発熱,悪寒,頭痛など)が出現し,血球減少や感染症のほか,免疫抑制によるB型肝炎ウイルス再活性化などの副作用が報告されている.進行期びまん性大細胞型B細胞リンパ腫(DLBCL)を対象としたランダム化試験では,リツキシマブ併用CHOP療法はCHOP療法よりもすぐれていた.また進行期低悪性度B細胞リンパ腫(濾胞性リンパ腫など)に対してもリツキシマブ併用化学療法が標準的治療と見なされている.CD20使用後に再発した一部のリンパ腫では,CD20の発現低下も報告されている.
2)イットリウム(90Y)イブリツモマブチウキセタン:
イブリツモマブチウキセタンは,遺伝子組換え技術によって産生される抗CD20 マウスモノクローナル抗体で,これにキレート剤(チウキセタン)を介して90Yが結合する.90Yから放出されるβ線によってリンパ腫細胞が殺傷される.難治性のCD20陽性B細胞性非Hodgkinリンパ腫の治療薬として,2008年に承認された.
3)ゲムツズマブオゾガマイシン(gemtuzumab ozogamicin:GO):
遺伝子組換え技術によって産生される抗CD33ヒト化モノクローナル抗体にリンカーを介して抗腫瘍抗生物質カリケアマイシンが結合している.CD33は単球や顆粒球など骨髄系細胞に発現しているが,正常造血幹細胞には発現していない.また急性骨髄性白血病の80%以上で陽性である.GOの抗体部分が細胞表面に発現しているCD33と結合すると,細胞内に取り込まれ,細胞のライソゾームの消化酵素によってリンカーが分解する.カリケアマイシンが遊離し,核内でDNAと結合してDNAを切断し,標的細胞に細胞死を引き起こす.2005年に再発または難治性のCD33 陽性の急性骨髄性白血病に承認された.
b.低分子化合物
ⅰ)チロシンキナーゼ阻害薬
1)イマチニブ:
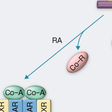
慢性骨髄性白血病(CML)の分子病態がフィラデルフィア(Ph)染色体であることに着目し,遺伝子産物BCR-ABLを標的とした分子標的薬として設計・開発されたチロシンキナーゼ阻害薬である(図14-7-4).わが国では2001年に承認され,Ph染色体陽性急性リンパ性白血病(Ph+ALL)およびKITチロシンキナーゼの異常活性が腫瘍の増殖に関与している消化管間質腫瘍(GIST)に対しても適応が追加されている.慢性期CML患者を早期に血液学的寛解導入するだけでなく,それまで標準薬とされてきたインターフェロンαと比べて格段にすぐれた細胞遺伝学的効果,さらに全生存率の向上をもたらす.副作用として,悪心や好中球減少などのほか,皮疹や浮腫が認められることがある.いくつかの耐性メカニズムが知られており,なかでも標的分子BCR-ABLのABL酵素触媒部分におけるアミノ酸点変異が,特に移行期・急転期に対する使用時において観察されることがある.
2)ニロチニブ:
ABLに対する親和性の向上を目的として分子設計され,高い選択性と強い阻害活性を有するチロシンキナーゼ阻害薬であり,T315I(ABL315番アミノ酸のスレオニンがイソロイシンに変換)を除く点変異に有効性を示す.慢性期CML患者を対象としたランダム化比較試験で,治療開始12カ月時点の分子学的大寛解(major molecular response:MMR,BCR-ABL転写物コピー数が1/1000以下に減少)率がイマチニブよりもすぐれている.わが国では2009年,イマチニブ抵抗性あるいは不耐容の患者に承認され,2010年より未治療CML患者にも適応が拡大された.3)ダサチニブ:
イマチニブとは構造的に異なり,ABLのほか,Srcファミリーキナーゼ,c-KIT,EphA2受容体およびPDGFRβに対する強力なチロシンキナーゼ阻害作用を有する.T315Iを除く点変異ABLにも有効性を示す.2009年にイマチニブ抵抗性のCML(慢性期,移行期および急性期)および再発または難治性のPh染色体陽性急性リンパ性白血病に承認された.慢性期CML患者を対象としたランダム化比較試験で,12カ月以内の細胞遺伝学的完全寛解(Ph染色体陽性の分裂中期細胞が20個中に検出されない状態)率は,イマチニブよりも高く,2011年に未治療CML患者にも適応が拡大された.
4)レチノイド(オールトランス型レチノイン酸,タミバロテン)・亜ヒ酸:
1988年に急性前骨髄球性白血病(APL)に対するオールトランス型レチノイン酸(ATRA,別名トレチノイン)によるすぐれた治療成績が中国から報告された.ATRA療法によってAPL細胞は徐々に分化傾向を呈し,治療1カ月過ぎには骨髄低形成を経ることなく正常造血が回復する.その後APLにおける15;17転座点の分子生物学的な解析が進み,転座によってPML-RARαキメラ転写因子が形成されること,キメラ転写因子はPMLならびにレチノイン酸受容体RARαに対して転写機能を抑制すること,また薬理学的濃度のATRAはこの機能抑制を解除するとともに,キメラ転写因子の分解を促進することが明らかになった.そのためATRAはPML-RARαを標的とした分子標的薬として位置づけられている.ATRA療法中に分化したAPL細胞が増加し,不明熱,呼吸困難,体重増加,胸水などを呈する分化症候群(differentiation syndrome)をきたすことがある.また長期間,単独で使用すると耐性が出現し,そのメカニズムとして,代謝の亢進などとともに,PML-RARαにおけるリガンド結合領域のアミノ酸点変異が知られている.タミバロテン(Am80)はわが国で開発された合成レチノイドで,ATRAよりも親水性が高く,RARαへの選択性・結合力に優れ,また分化誘導活性が高いとされている.再発または難治性APLを対象に2005年に承認された.三酸化二ヒ素(亜ヒ酸,ATO)もATRAと同じく中国で,経験から生まれた治療薬であるが,現在はATRA抵抗性のAPLにも有効であることが広く実証されている.わが国では2004年に承認された.ATOがAPLにのみ有効である機序は,ATOがPML-RARαにおけるPML部分にATOが結合しプロテアソームによるPML-RARα分解を引き起こすためと考えられている(図14-7-5).
ⅱ)エピジェネティクス制御薬
エピジェネティクスとは遺伝子の塩基配列によらない後天的な修飾により遺伝子発現の制御を行う機構であり,細胞分裂をこえてその情報は受け継がれる.エピジェネティクスにかかわる分子機構として,DNAメチル化,ヒストン修飾(アセチル化,メチル化,リン酸化など),非コードRNAなどがある.このうちDNAのCG配列(CpGアイランドともいい,遺伝子プロモーター部位に高頻度に認められる)におけるC(シトシン)のメチル化は遺伝子発現の抑制にかかわっている.癌細胞ではさまざまな遺伝子においてDNAメチル化状態が異常であることが示されている.これらDNAメチル化にかかわる酵素がDNAメチル化酵素DNAMTである.最近,骨髄系腫瘍ではDNAのメチル化・脱メチル化にかかわる酵素群の変異が高率に見いだされているが,阻害薬感受性との関連はいまだ明らかではない.
DNAは核内においてヒストンに規則正しく巻き付いてクロマチンを形成しているが,ヒストンのN末端のリジンやアスパラギン残基はアセチル化やメチル化などの化学修飾を受ける.特に,リジン残基のアセチル化はDNAとヒストンの結合を緩め,遺伝子の転写を活発に行うのに重要である.ヒストンのアセチル化はヒストンアセチルトランスフェラーゼ(HAT),ヒストン脱アセチル化酵素(HDAC)によって触媒される.
1)ボリノスタット:
米国で分化誘導薬として報告され,その後ヒストン脱アセチル化酵素阻害薬であることが明らかになった.クラスⅠ(HDAC1,2および3)およびクラスⅡ(HDAC6)のHDACの触媒ポケットに直接結合し,その酵素活性を阻害する.HDAC活性の阻害は転写制御を通じて,抗腫瘍作用を発揮するものと考えられている.HDAC阻害の作用機序を有する薬剤としては,ボリノスタットははじめての抗悪性腫瘍薬である.わが国では難治性の皮膚T細胞性リンパ腫(CTCL)患者の皮膚病変の治療を適応として2011年に承認された.
2)アザシチジン:
アザシチジンはシチジン誘導体であり核酸合成阻害薬として化学的に合成された.アザシチジンは殺細胞作用を有していることから,抗癌薬として開発されてきた.1980年代より,アザシチジンがDNAメチル化を阻害し細胞分化を誘導することや,癌とDNAメチル化との関連性が示唆されるに伴い,骨髄異形成症候群(MDS)に対する治療薬として注目された.MDS患者を対象とする臨床試験で,アザシチジン投与例の半数以上で血液学的改善などの効果が認められ,アザシチジン投与により急性骨髄性白血病(AML)移行までの期間および生存期間の延長傾向,MDSの自然経過を改善する可能性が示されている.わが国では,2011年に承認された.
3)プロテアソーム阻害薬(ボルテゾミブ):
プロテアソームは細胞内に存在する酵素複合体で,ユビキチン修飾を受けた蛋白質を特異的かつ急速に分解する作用を有している.ボルテゾミブは,プロテアソームの触媒サブユニットの1つであるβ5に結合して,プロテアソームを特異的かつ可逆的に阻害する.その結果,NFκBを含む複数のシグナル伝達経路に影響を及ぼし,血管新生抑制,骨髄ストローマ細胞との接着抑制およびサイトカイン分泌抑制など腫瘍周囲微小環境にも作用して抗腫瘍効果を発揮すると考えられている.副腎皮質ステロイドあるいは化学療法のみの治療に比較し,ボルテゾミブの併用は奏効率・生存率ともにすぐれていることが示されている.副作用は血球減少のほか,肺障害や末梢性ニューロパチーなどが報告されている.わが国では2006年に再発・難治の多発性骨髄腫に承認され,2011年に未治療症例へ適応拡大された.[直江知樹]
出典 内科学 第10版内科学 第10版について 情報