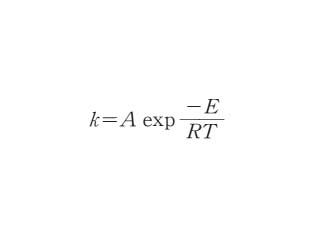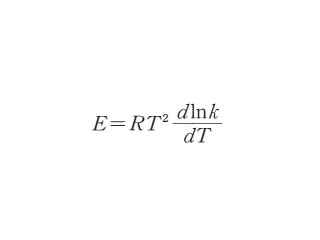アレニウスの式 (アレニウスのしき)
Arrhenius' equation
化学反応の速度は一般に温度によってかなり大きく変化し,速度定数kと絶対温度Tとの間に近似的に次の関係式が成り立つ。
k=A exp(-Ea/RT)
ここでRは気体定数,AおよびEaは反応に固有の定数で,Aは頻度因子,Eaは活性化エネルギーと呼ばれる。この関係は1889年スウェーデンのS.A.アレニウスにより提出されたもので,アレニウスの式と呼ばれる。この関係はかなり広い範囲で成り立ち,また活性化された分子間の衝突により反応が起こると考えることによって,Eaは活性化のために必要なエネルギー,Aは単位時間あたりの衝突回数という明らかな意味をもつので,現在でも広く用いられている。
→反応速度
執筆者:妹尾 学
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
アレニウスの式
アレニウスのしき
Arrhenius' equation
スウェーデンの化学者 S. A.アレニウスが 1889年に化学反応速度定数 k と絶対温度 T との関係を表わす式として提出したもので,次のように表わされる。
k=A exp (-E/RT)
R は気体定数,E は反応が起るためにこえるべきエネルギー壁の高さ,すなわち活性化エネルギーに相当し,A は単位時間に衝突する分子の数 z と,立体因子 P (衝突した分子のうち,反応を生じる条件に適した方向より衝突した分子の数の割合) との相乗積,すなわち A=Pz で表わされ,頻度因子という。この式はイオン反応などの高速反応を除き,均一な気相や液相の反応,不均一な接触反応や固体反応など一般の化学反応,および粘性や拡散などの動力学的な現象にも広く適用される。 (→反応速度 )
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
法則の辞典
「アレニウスの式」の解説
アレニウスの式【Arrhenius' equation】
反応速度定数の温度依存性を表す実験式.反応速度定数 k は気体定数を R,絶対温度を T としたとき
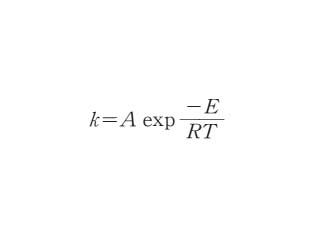
の形となる.ここで E は見かけの活性化エネルギー,A は頻度因子である.温度範囲が広いと E は必ずしも一定値とは見なせない(温度の関数である)が,上の式の微分形から
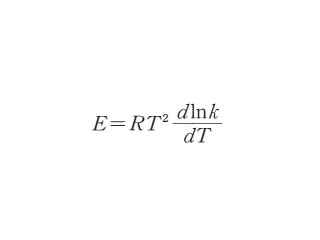
から E を求めることができる(こちらをアレニウスの式と呼ぶこともある).
出典 朝倉書店法則の辞典について 情報
Sponserd by 
アレニウスの式
化学反応で,反応速度定数と温度との関係を表す式.k=Aexp(−E/RT).T:絶対温度,k:反応速度定数,R:気体定数,A:頻度因子,E:活性化エネルギー.
出典 朝倉書店栄養・生化学辞典について 情報
Sponserd by