化学辞典 第2版 「キセノン化合物」の解説
キセノン化合物
キセノンカゴウブツ
xenon compound
水,ヒドロキノンなどとのクラスレート化合物(包接化合物)や,分光学的にのみ観測される Xe2,XeH+などがキセノンの化合物として考えられていたが,1962年にN. Bartlettにより偶然,通常の意味の化合物であるXePtF6が得られた.その後,続々とXeの化合物が得られている.【Ⅰ】フッ化物:XeF2,XeF4,XeF6([別用語参照]フッ化キセノン).フッ化物は強力なフッ化剤である.【Ⅱ】酸化フッ化物,酸化物:XeF6の加水分解により,酸化四フッ化キセノンXeOF4,二酸化二フッ化キセノンXeO2F2が得られる.
XeF6 + H2O → XeOF4 + 2HF
XeOF4 + H2O → XeO2F2 + 2HF
XeOF4は常温で無色透明の流動性の液体(融点-46.2 ℃)で,ニッケル容器中では安定であるが,石英容器中では,
XeOF4 + SiO2 → SiF4 + XeO3
のように徐々に反応して爆発性のXeO3をつくる.XeO2F2は常温で不安定な無色の結晶.融点30.8 ℃.三酸化二フッ化キセノンXeO3F2は,XeF6と過キセノン酸ナトリウムNa4XeO6を室温で反応させると得られる.加水分解がさらに進むと潮解性の白色の結晶としてXeO3が得られる.XeF4も加水分解してXeO3をあたえる.
XeO2F2 + H2O → 2HF + XeO3
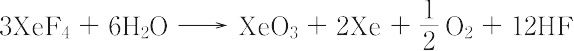
きわめて敏感な爆発性の化合物で,爆発力はTNTに匹敵する.Xeを頂点とする三角すい型分子で,Xe-O0.174,0.176,0.177 nm.濃硫酸でNa4XeO6,Ba2XeO6を処理すると,XeO4が不安定な揮発性の化合物として得られる.固体は爆発性が強く,-40 ℃ でも爆発する.【Ⅲ】キセノン酸,過キセノン酸:XeO3の水溶液はごく弱い酸性を示し,キセノン酸(xenic acid)とよばれる.強塩基性溶液中では,おもにHXeO4-として存在するとされる.徐々に不均化反応が起こり,過キセノン酸(ヘキサオキソキセノン(Ⅷ)酸)イオンと Xe0 に変わる.
2HXeⅥ O4- + 2OH- → XeⅧ O64- + Xe0 + O2 + 2H2O
XeO64-水溶液は非常に強力な酸化剤で,容易にハロゲン化物イオンをハロゲンに,MnⅡをMnⅦ O4-に酸化する.アルカリ金属(M = Na,K,Rb,Cs)のキセノン酸塩MHXeO4はキセノン酸のMOH水溶液による滴定で得られ,常温では安定な無色の結晶である.過キセノン酸イオンXeO64-は八面体型構造で,Xe-O0.184~0.188 nm で酸化物中のXe-O結合より長い.過キセノン酸(perxenic acid)H4XeO6は強酸で第1段のpKa1 -3~0(pKa2 4.3,pKa3 10.8).過キセノン酸塩は上記のNa,Baのほか,K,Pb,Ag,Cu,Znなど多くのものが得られている.【Ⅳ】錯塩:最初に合成の報告されたXePtF6は意外に複雑で,~20 ℃ でXeとPtF6気体をまぜただけで得られる赤みを帯びた黄色の固体はXe(PtF6)x,1 ≦ x ≦ 2で,X線回折像はXeF+PtF6-の存在を示す.Xe(MF6)x型の錯塩としては,M = Ru,Rhのものなどがある.AuXe42+は,貴金属-貴ガス間の共有結合をもつめずらしい錯イオンで,-40 ℃ まで安定な暗赤色の結晶AuXe42+[Sb2F11]2として得られた.AuXe42+は平面正方形型で,Au-Xe0.274 nm.【Ⅴ】低温剛性溶媒中の化合物:10 K 前後のキセノン剛性溶媒中で,HXeH,HXeOH,HXeBr,HXeCN,HXeNCO,アセチレンへの挿入化合物HXeCCH,HXeCC,HXeCCXeHまで得られ,Xe原子がH,C,N,Br原子とも結合することが赤外スペクトルなどで確かめられている.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

