翻訳|acetylene
精選版 日本国語大辞典 「アセチレン」の意味・読み・例文・類語
アセチレン
- 〘 名詞 〙 ( [英語] acetylene )
- ① アセチレン系炭化水素の一つ。化学式 C2H2 無色の有毒性気体。カーバイド(炭化カルシウム)に水を加えると得られる。工業的には石油、天然ガス、コークス炉ガスなどからの低級炭化水素類を高温で分解して製造する。酸素との混合ガスは爆発性がある。灯火用・溶接用に用いるほか、工業用薬品、合成樹脂、合成繊維、合成ゴムなど、化学工業原料としても重要。アセチレンガス。エチン。
- ② 「アセチレンとう(━灯)」の略。
- [初出の実例]「アセチレンの灯が暗いのでよく判らなかった」(出典:一千一秒物語(1923)〈稲垣足穂〉月のサーカス)
改訂新版 世界大百科事典 「アセチレン」の意味・わかりやすい解説
アセチレン
acetylene
三重結合をもつ不飽和鎖式炭化水素(アルキン)のうちで最も簡単なもの。化学式HC≡CH。1836年にイギリスのH.デービーによって初めて見いだされた。工業的には,カルシウムカーバイド(カーバイド)から製造されるか,または石油の高温熱分解法によって製造される。おもな用途は,灯火用,溶接用,合成化学原料などである。
性質
常温・常圧下では無色,無臭の可燃性の気体で,沸点-83.6℃。カーバイドに水を加えて発生させたアセチレンは,微量の不純物を含むため特異な臭気をもっている。爆発範囲が広く,1気圧の空気中では2.5~80.5%(容積)の濃度で爆発を起こす可能性がある。また圧縮すると分解,爆発を起こしやすい。そこで,アセチレンをボンベ(高圧容器)に充てんするときは,ボンベ中にケイ藻土やアスベスト(石綿)を詰め,アセトンをしみこませたうえ,アセチレンを10~15気圧まで充てんする。アセトンはアセチレンのよい溶媒であり,15℃ではアセトン1容にアセチレン25容が溶解する。銅,銀,水銀などの金属と反応して,爆発性のアセチリドを生成する。燃焼熱は301.5kcal/molで水素や天然ガスなどよりずっと大きく,アセチレンを酸素によって燃焼させれば,約3000℃の高温が得られる。この高温を利用して,アセチレンは金属の切断や溶接に用いられる(酸素アセチレン炎)。なお,アセチレンは800℃以上の高温では不安定で,水素と炭素に分解する傾向がある。この分解反応は発熱反応であるので,これを利用して,アセチレンからカーボンブラックを製造することができる。このカーボンブラックはアセチレンブラックacetylene blackとも呼ばれ,電池用導電材などに用いられる。
製法
(1)カーバイド法 カーバイドCaC2に水を加えると,次式によりアセチレンが発生する。
CaC2+2H2O─→HC≡CH+Ca(OH)21tのカーバイドから約300m3(0℃,1気圧換算)のアセチレンが得られる。このアセチレン中には硫化水素,ホスフィン,アンモニアなどの不純物がわずかながら含まれているので,合成化学原料として利用する場合には,これらの不純物を分離し,精製する。カーバイドは石炭と石灰石を原料とし,電気炉で約2000℃の高温で反応させて製造される。したがって,石炭や電力の価格が高い場合は,次の石油系アセチレンにくらべてコスト高になる。
(2)石油の高温熱分解法 メタンCH4,エタンC2H6,プロパンC3H8あるいはナフサなどの石油系炭化水素を1100~1400℃の高温で分解するとアセチレンが得られる。
2CH4─→HC≡CH+3H2
2/3C3H8─→HC≡CH+5/3H2
これらの反応は大きな吸熱反応であり,また生成したアセチレンは不安定であるから,原料の炭化水素を急速に加熱して分解し,その反応生成物を急速に冷却する必要がある。このために,次に述べるようないろいろな工夫がされている。
(a)電弧法。直流または交流のアーク(たとえば7000V,1150A)に炭化水素原料を吹き込む。分解ガスが一酸化炭素などを含まないため,アセチレンの分離,精製が容易である反面,電力のコストが問題である。(b)火炎分解法。燃料ガスを酸素を用いて燃焼し,その高温火炎中に炭化水素原料を吹き込む。(c)部分燃焼法。原料炭化水素の一部分を酸素によって燃焼し,その発熱を利用してアセチレンを得る。(d)蓄熱炉法。耐火煉瓦製の,伝熱面積の大きい炉を燃焼ガスで高温に加熱したのち,原料炭化水素を吹き込む。吸熱反応である分解が進むと炉内温度が低下するので,原料の供給を停止し,燃料と空気を導入して炉を再度加熱する。これらの燃焼熱を利用する分解法((b)~(d))では,生成ガス中に一酸化炭素や二酸化炭素が混入することになり,アセチレンの分離・精製工程が複雑になる。この工程は一般に次の順序で行われる。(1)タール除去→(2)ガス圧縮→(3)二酸化炭素除去→(4)高級アセチレン除去→(5)アセチレン分離→(6)エチレン回収。(5)の目的には溶媒としてジメチルホルムアミド,メタノール,液体アンモニアなどが用いられ,-50~-70℃の低温で操業される。(e)高温水蒸気(約2000℃)を用いた原油熱分解によるアセチレン製造法。この場合には,分解温度が比較的低いため,エチレンがかなり副産される。生成ガス中のアセチレンは塩化水素の付加反応を利用して塩化ビニルとして分離し,エチレンは塩素化して塩化エチレンとして回収する。塩化エチレンは熱分解して塩化ビニルとし,このとき副生する塩化水素をアセチレンへの付加反応に利用する。
用途
酸素アセチレン炎として金属の溶断または溶接に用いられること,またカーボンブラック(アセチレンブラック)をつくり,それを電極製造に使うことなどは前述のとおりであるが,ここでは合成化学工業における用途を示す。アセチレン系誘導体の多くは,石油化学工業で生産されるエチレンからも合成することができるので,1960-70年代の石油化学全盛時代にはアセチレン系合成化学は不振であった。しかし,石油価格が大きく上昇すれば,石炭系アセチレン化学が復活する可能性もありえよう。アセチレンからの主要な誘導体は図1に示すとおりである。このほか,レッペW.J.Reppeによって発見された多彩なアセチレン系合成化学反応がある。
→レッペ反応
執筆者:冨永 博夫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「アセチレン」の意味・わかりやすい解説
アセチレン
あせちれん
acetylene
アルキン(アセチレン系炭化水素)のもっとも簡単なもの。正式な命名法に従うと、エチンethyneというが、慣用名のアセチレンが頻用される。天然には存在せず、1836年イギリスの大化学者H・デービーのいとこであるデービーEdmund Davy(1785―1857)により発見された。
無色で純粋なものは無臭の気体。元来は炭化カルシウム(カルシウムカーバイド、生石灰を無煙炭またはコークスと電気炉中で加熱して製造)に水を作用させて製造した。この方法で得られるアセチレンは不純物のため悪臭を有する。現在、工業的には天然ガスやナフサなど石油からの炭化水素を高い温度で熱分解して製造する。その分子は次のような直線状の構造をとる。
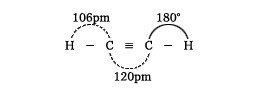
炭素‐炭素三重結合の間隔は二重結合よりも短く、またそれに結合する水素との結合間隔もエチレンの場合のそれよりも短い。
常温ではほぼ同体積の水にしか溶解しないが、アルコールやベンゼンなどの有機溶媒には溶け、とくにアセトンにはよく溶ける。アセチレンは高圧で分解しやすいため、珪藻土(けいそうど)にしみ込ませたアセトンに加圧して溶かし、ボンベで運搬する。
アセチレンは燃焼すると発熱量が大きいので、酸素と混ぜて酸素アセチレン炎として、鉄の溶接や切断に用いる。また空中で点火すると、輝きの強い炎で燃えるので、夜店などでアセチレンランプとして用いられる。しかし、アセチレンの酸素または空気との混合ガスはきわめて爆発しやすいので、取扱いには充分の注意が必要である。アセチレンが空気中に2.5~81%含まれていると爆発する。
アセチレンは三重結合をもつので、付加や重合をおこしやすい。水と付加すればアセトアルデヒドを生じる。ハロゲンやハロゲン化水素と付加して1,2-ジハロエチレンや塩化ビニルなどのハロゲン化オレフィンを生ずる。また適当な触媒を用いてアセチレンを加圧下で反応させるレッペ反応により、さらに多くの付加反応を行うことができる。アセチレンの水素原子は酸性であるので、金属で置換されやすく、金属アセチリドを生ずる。しかし、銀や銅などの重金属のアセチリドは爆発性である。
かつて石炭を利用していたころには、石炭を原料として、安価な電力を用いてカーバイドを生産し、これからアセチレンを製造し、それを原料として合成繊維やプラスチックを製造する工業が盛んであり、そのための工場も電力、石炭、石灰石を得やすい場所に立地した。1950年代、アセチレンに水を付加させてアセトアルデヒドを製造する工程で、触媒として用いた水銀化合物が環境の深刻な汚染をもたらした。しかし、現在では石油化学工業の発達に伴い、エチレンにとってかわられた。
[徳丸克己]
アセチレン(データノート)
あせちれんでーたのーと
アセチレン
HC≡CH
分子式 C2H2
分子量 26.04
融点 -81.8℃
沸点 -83.6℃
比重 液体 0.613(測定温度-80℃)
個体 0.730(測定温度-85℃)
引火点 35.18℃
化学辞典 第2版 「アセチレン」の解説
アセチレン
アセチレン
acetylene
C2H2(26.04).HC≡CH.エチン(ethyne)ともいう.実験室的には,カーバイドから製造される(カーバイドアセチレン).工業的には,おもに石油系炭化水素の火炎分解法(あるいは蓄熱炉法,部分燃焼法,アーク分解法)によって製造される(石油アセチレン).無色で,ほとんど臭いのない気体.融点-81.8 ℃,沸点-83.6 ℃.臨界温度35.2 ℃.臨界圧力60.6 atm.生成熱(25 ℃)226.3 kJ mol-1.燃焼熱(25 ℃)1261.5 kJ mol-1.爆発範囲(空気中,1 atm)2.5~80.5体積%.水1容に1.1容(15 ℃),アセトン1容に25容(15 ℃)溶ける.アセチレンは酸素で燃焼させると3000 ℃ を超す温度が得られるので,溶断用に使用されている.圧縮すると分解爆発を起こしやすいために,容器へ直接圧縮充填せずに,木炭などの多孔質物質を高圧容器内に詰め,これにアセトンを溶媒として浸み込ませたものにアセチレンを溶解充填して使用する(溶解アセチレン).銅,銀および水銀などの金属と直接反応して,爆発性のアセチリドを生成する.かつては各種有機化合物の合成原料として用いられたが,石油化学工業の発展に伴い,エテン,プロペンなどにとってかわられた.[CAS 74-86-2]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「アセチレン」の意味・わかりやすい解説
アセチレン
→関連項目ガス化学工業|カーバイド|石炭化学|石炭化学工業
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「アセチレン」の意味・わかりやすい解説
アセチレン
acetylene
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内のアセチレンの言及
【ガス化学工業】より
…ガスを原料とする化学工業のことであるが,一般には,天然ガスを原料として有機化学工業の中間原料であるメタノール(メチルアルコール),アセチレン,アンモニアなどを製造する分野をいう。ガス化学工業という分類は日本特有のものである。…
※「アセチレン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...