化学辞典 第2版 「グリコシル化」の解説
グリコシル化
グリコシルカ
glycosylation
グリコシド化により,ある化合物にグリコシル基が導入される過程をいう.オリゴ糖を合成する場合は,ヘミアセタール性ヒドロキシ基を活性化されやすい脱離基に変換してグリコシル供与体(glycosyl donor)とし,活性化剤を加えてグリコシル受容体(glycosyl acceptor)のグリコシル化を行うのがもっとも一般的である.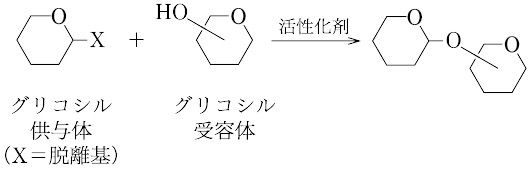 この反応の立体選択性はアノマー効果に支配され,アキシアルグリコシド(多くの場合,α-グリコシド)が優先して生成する傾向がある.しかし,2位にエクアトリアル配向のエステルがある場合は,隣接基関与によりエクアトリアルグリコシド(多くの場合,β-グリコシド)が立体特異的に生成する.使用する溶媒や試薬の種類によっても立体選択性の制御が可能である.オリゴ糖合成には,おもに次にあげる四つのグリコシル化法がよく用いられている.
この反応の立体選択性はアノマー効果に支配され,アキシアルグリコシド(多くの場合,α-グリコシド)が優先して生成する傾向がある.しかし,2位にエクアトリアル配向のエステルがある場合は,隣接基関与によりエクアトリアルグリコシド(多くの場合,β-グリコシド)が立体特異的に生成する.使用する溶媒や試薬の種類によっても立体選択性の制御が可能である.オリゴ糖合成には,おもに次にあげる四つのグリコシル化法がよく用いられている.
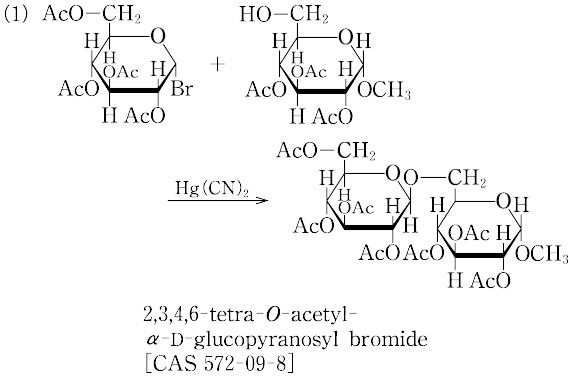
(1)ケーニヒス・クノール法(Köenigs Knorr's method):グリコシル供与体としてグリコシルブロミドかクロリド,活性化剤として銀塩を使う方法で,古くから知られ,現在でも頻繁に使用されている.銀塩としては,銀トリフラートAgOSO2CF3,酸化銀,過塩素酸銀AgClO4,硝酸銀,銀シリケート(Ag-silicate)などが用いられる.コリジンやテトラメチル尿素などの酸捕そく剤,およびモレキュラーシーブなどの吸湿剤を共存させて反応を行うのが一般的である.グリコシルブロミドおよびクロリドは一般に不安定であり,精製・保存は困難である.
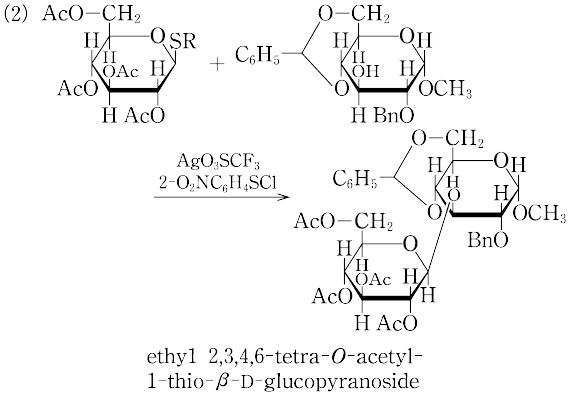
(2)チオグリコシドの利用:チオグリコシドをグリコシル供与体として用いる方法.チオグリコシドは多くの反応条件において不活性なため,そのまま保護基の変換などの種々の化学変換を行うことができる.一方,N-ヨードコハク酸イミドとトリフルオロメタンスルホン酸CF3SO3Hの混合物のようなハロゲン化剤,メチルトリフルオロメタンスルホン酸CF3SO3CH3のようなアルキル化剤などの求電子剤により活性化され,容易にグリコシル化反応が進行する.
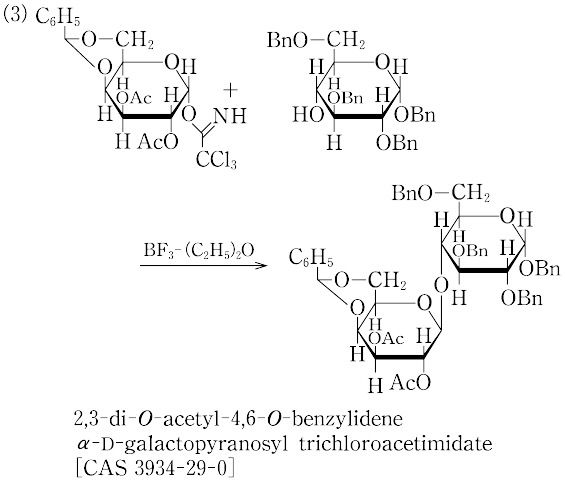
(3)ルイス酸による活性化:グリコシルフルオリド,グリコシルトリクロロアセトイミデートなどをグリコシル供与体とし,トリメチルシリルトリフルオロメタンスルホネートCF3SO3Si(CH3)3などのルイス酸を活性化剤とする方法.これらのグリコシル供与体は比較的安定で,精製・保存が可能な場合が多い.
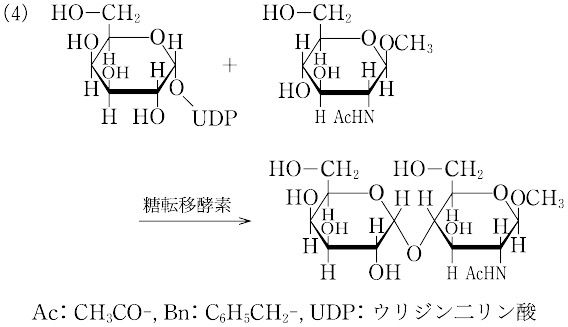
(4)糖転移酵素の利用:生体内での糖鎖合成と同様に,糖ヌクレオチドをグリコシル供与体として,糖転移酵素によりグリコシル化を行うことができる.糖転移酵素を用いると,保護基がなくても位置・立体選択的なグリコシル化反応が起こるので,非常に容易にオリゴ糖が合成できる.しかし,天然型の糖鎖しか合成できないことと,糖ヌクレオチドや糖転移酵素が入手困難であるという制約がある.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

