化学辞典 第2版 「シュウ酸鉄」の解説
シュウ酸鉄
シュウサンテツ
iron oxalate, ferrous, ferric oxalate
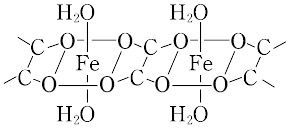
FeⅡの塩と,FeⅢの塩(中性塩,酸性塩,塩基性塩)とが知られている.【Ⅰ】FeⅡ C2O4(143.86).天然に鉱石としてフンボルチン(humboldtine)FeC2O4・2H2Oを産出する.FeⅡの塩の水溶液にシュウ酸またはその塩を加えるか,鉄をシュウ酸水溶液に溶かして濃縮すると二水和物が得られる.淡黄色の結晶.単斜晶系と斜方晶系の2形があり,いずれも図のようにFeのまわりはO原子による正八面体六配位で,鎖状につながっている.Fe-O約2.07 Å(H2O),2.14 Å(C2O4).密度2.28 g cm-3.
空気中でも比較的安定である.真空中で加熱すると,142 ℃ で無水物となり,190 ℃ でCO,CO2を発生して,あとに可燃性のFeOが残る.空気中では約160 ℃ で分解する.水,シュウ酸水溶液に難溶,HClに微溶,シュウ酸のアルカリ塩水溶液に可溶.写真の現像,ガラスの着色剤(サングラス,鉄道車両の遮光ガラスなど),プラスチックやペイントの顔料などに用いられる.[CAS 516-03-0]【Ⅱ】FeⅢ2(C2O4)3(375.75).25 ℃ で約65% の硝酸中で,硝酸鉄(Ⅲ)Fe(NO3)3・9H2Oとシュウ酸とを反応させ,濾液を硫酸上で蒸発濃縮すると五水和物が得られる.また,Fe(OH)3とシュウ酸水溶液との反応からは四水和物が得られる.前者は黄色,後者は黄緑色の結晶.水に可溶.水溶液はKSCNでは着色しないが,K4[Fe(CN)6]では青色沈殿を生じ,NaOHではFe(OH)3を沈殿する.強い光で分解して,FeⅡ C2O4とCO2を生じる.
2[Fe(C2O4)3]3- → 2FeⅡ C2O4 + 3C2O42- + 2CO2
過剰のシュウ酸カリウムを含む水溶液に溶け,化学光量計に用いられるトリス(オキサラト)鉄(Ⅲ)酸カリウムK3[Fe(C2O4)3]を生じる.触媒,写真印画紙などに用いられるほか,トリス(オキサラト)鉄錯体製造原料となる.[CAS 2944-66-3]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

