化学辞典 第2版 「当量イオン伝導率」の解説
当量イオン伝導率
トウリョウイオンデンドウリツ
equivalent ion conductance, ionic equivalent conductivity
電解質溶液において,ある特定のイオンについて,その単位当量濃度当たりの電気伝導性を表す量.その値は1当量のイオンが単位電場の強さ(通常1 V cm-1)のもとで移動するときの電流密度に数値的に等しい.イオンiの移動度を ui とすれば,当量イオン伝導率 λi は次式で与えられる.
λi = Fui (F:ファラデー定数)
1種類の電解質(Mν+z+ Aν-z-)のみを含む溶液について考えると,濃度をc(モル濃度)あるいは ce(当量濃度),解離度をαとすれば,この電解質溶液の比電気伝導率κ,当量電気伝導率Λおよびモル伝導率Λm は,カチオン Mz+ およびアニオン Az- の当量イオン伝導率 λ+ および λ- により次式で表される.
κ = αcνz(λ+ + λ-)/1000 = α ce(λ+ + λ-)/1000
Λ = α(λ+ + λ-),Λm = ανz(λ+ + λ-)
(ただし,νz ≡ ν+z+ = ν-|z-|)
無限希釈溶液では,すべての電解質は完全解離する(α = 1)と考えられるから,
Λ∞ = λ+∞ + λ-∞
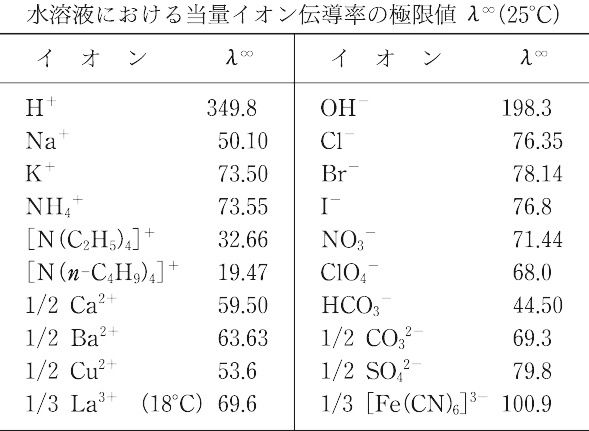
ここで,λ+∞ および λ-∞ はそれぞれカチオンおよびアニオンの当量イオン伝導率の極限値である.さらに無限希釈の状態では,イオン間の相互作用を無視することができるので,個々のイオンの挙動はそのイオン自身の性質と溶媒の性質(温度,圧力,粘度など)だけによって決定されると考えられ,無限希釈における当量イオン伝導率の極限値 λ∞ は,共存イオンの種類には関係なく,そのイオンに固有なものとなる.この概念はF.W.G. Kohlrauschのイオン独立移動の法則(コールラウシュの法則)として知られている.表に代表的なイオンに対する λ∞(cm2 Ω-1 equiv-1)の値をあげる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

