内科学 第10版 「急性進行性糸球体腎炎」の解説
急性進行性糸球体腎炎(原発性糸球体疾患)
急速進行性糸球体腎炎は,数週から数カ月の経過で急性あるいは潜在性に発症し,血尿(多くは顕微鏡的血尿,まれに肉眼的血尿),蛋白尿,貧血を伴い,急速に腎機能障害が進行する,最も予後不良な腎炎症候群である.病理学的には,多数の糸球体に細胞性から線維細胞性の半月体の形成を認める半月体形成性(管外増殖性)壊死性糸球体腎炎(crescentic(extracapillary)and necrotizing glomerulonephritis)が典型像である.しかし,半月体形成性壊死性糸球体腎炎以外にもRPGNの臨床経過をたどるものがあり,広く腎炎様の尿所見を伴い,急速に腎機能の悪化により,放置すれば末期腎不全まで進行する臨床症候群として取り扱われ,その多くが病理学的診断名である半月体形成性壊死性糸球体腎炎を呈するものと定義される.
分類
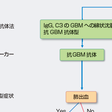
RPGNの病型分類を図11-3-4に示す.
腎生検の蛍光抗体法所見から,①糸球体係蹄壁に免疫グロブリン(多くはIgG)の線状沈着を認める抗糸球体基底膜(glomerular basement membrane:GBM)抗体型(図11-3-5A),②糸球体に免疫グロブリンなどの沈着を認めないpauci-immune型,③糸球体係蹄壁やメサンギウム領域に免疫グロブリンや免疫複合体の顆粒状の沈着を認める免疫複合体型(図11-3-5B),の3型に分類される.さらに,血清マーカー,症候や病因を加味しての病型分類が可能で,抗GBM抗体型で肺出血を合併する場合にはGoodpasure症候群【⇨11-6-10)】,腎病変に限局する場合には抗GBM型RPGN,pauici-immune型の中で全身性の血管炎症候を伴うものが顕微鏡的多発血管炎(microscopic polyangitis: MPA),腎臓のみに症候をもつ腎限局型血管炎(renal limited vasculitis)とする分類もある.
さらに最も症例数の多いpauci-immune型の大半は抗好中球細胞質抗体(anti-neutrophil cytoplasmic antibody:ANCA)が陽性であり,そのサブクラスにより核周囲型(peri-nuclear)(MPO)-ANCA(図11-3-5C)と細胞質型(cytoplasmic)(PR3)-ANCA(図11-3-5D)に分類される.
疫学
わが国のRPGNによる1998年度年間受療患者数1500人から2003年度年間の受療患者数3700人に推計され,約2.5倍に増加していた.2008年度のわが国のRPGNによる新規受療者は約1500〜1800人と推定された.一方,わが国でRPGNにより透析導入となる患者数は1994年の145人から2010年の446人に約3.1倍増加しており,透析導入原疾患の中で第5位を占めている.
RPGN患者の中では抗GBM抗体型,顆粒状沈着型,pauci-immune型の比率は1:3:11の比率で圧倒的にpauci-immune型が多い.PR3-ANCA単独陽性例は有意に若年に多く,抗GBM抗体同時陽性例は女性に多く,PR3-ANCA単独陽性例は男性に多い(Yamagataら, 2012).
病理・病態生理
糸球体の半月体形成は基底膜やメサンギウム基質といった細胞外基質の壊死により始まり,糸球体毛細血管レベルの壊死性血管炎が本態である.血管壁の破綻によりBowman腔内に析出したフィブリンは,さらなるマクロファージのBowman腔内への浸潤とマクロファージの増殖をきたす.この管外増殖性変化により半月体形成が生じる.半月体はBowman囊の内側,尿腔に細胞成分,フィブリン,基底膜物質,膠原線維などで形成される構造物である.半月体はその病期により,細胞性,線維細胞性,線維性半月体に分類される.細胞性半月体はBowman腔に2層以上の細胞層が形成されるものと定義される(図11-3-5E,F).細胞性半月体は可逆的変化とされているが,適切な治療を行わないと,非可逆的な線維細胞性半月体から線維性半月体へと変貌を遂げる.
臨床症状
1)自覚症状:
RPGNの初発症状としては,全身倦怠感(44.0%),発熱(42.0%),食欲不振(32.1%),上気道炎症状(26.2%),関節痛・筋肉痛(16.7%),悪心・嘔吐(15.4%),体重減少(11.8%)などの非特異的症状が大半で,自覚症状を完全に欠いて検尿異常,血清クレアチニン異常の精査で診断に至る例も少なくない.全身性疾患に伴うRPGNでは,その原因となる全身性疾患による症状を伴う.おもなものとしては,関節痛・関節炎(16.9%),紫斑(9.1%),紅斑(5.2%),末梢神経傷害(6.9%)などである.MPAでは,血管炎による紫斑,皮膚潰瘍,多発性単神経炎によるしびれ,運動麻痺などの神経症状,関節痛などがみられることが多い.また合併する肺病変により,咳,血痰,呼吸困難などを認める.
2)他覚症状:
腎症候として多いものは浮腫(35.6%),肉眼的血尿(12.2%),乏尿・無尿(8.5%),ネフローゼ症候群(8.0%),急性腎炎症候群(5.6%),尿毒症(3.5%)などである.肺病変特に間質性肺炎の合併(14.6%)がある場合,下肺野を中心に湿性ラ音を聴取する.
検査成績
1)一般検査所見:
腎機能障害を反映して,BUN,血清クレアチニンの上昇,糸球体濾過値(GFR)の低下を認める.腎機能の悪化スピードは原疾患により異なる.尿所見では,血尿は必発,ときに肉眼的血尿を認め,蛋白尿は軽度からネフローゼレベルまでさまざまである.また炎症所見としてのCRP高値,赤沈の亢進を認める.正球性正色素性貧血を認め,その程度は腎機能の割に高度のことが多い.
2)血清マーカー:
ANCAの陽性頻度でみるとANCA陽性例中MPO-ANCAのみ陽性例は85.6%,PR3-ANCAのみ陽性例は4.1%,両陽性,抗GBM抗体との同時陽性例を含めたMPO-ANCAの陽性頻度は95.4%である.抗GBM抗体単独陽性例は5.0%である.これらの血清マーカーは診断的価値と同時に治療効果の判定や,再発の早期発見などに有用で,経時的な変化をモニターする.
3)画像検査:
腎の超音波あるいはCT検査では腎のサイズは正常から軽度腫大している.また胸部単純X線異常を23.1%の患者に認める.おもな異常としては間質性肺炎像(14.6%)や肺胞出血(11.2%)であり,肺CT検査が病変の評価には有用である.
診断
RPGNは早期発見による早期治療開始が予後を大きく左右する.したがって,①RPGNを疑い,②本症の確定診断,③治療方針決定のための病型診断の3段階の診断を速やかに行う必要がある.
1)早期診断のための指針:
①血尿,蛋白尿,円柱尿などの腎炎性尿所見を認める,②GFRが60 mL/分/1.73 m2未満,③CRP高値や赤沈亢進を認める.以上の3検査所見を同時に認めた場合,RPGNを疑い,腎生検などの腎専門診療の可能な施設へ紹介する.なお,急性感染症の合併,慢性腎炎に伴う緩徐な腎機能障害が疑われる場合には,1~2週間以内に血清クレアチニン値を再検する.また腎機能が正常範囲内であっても,腎炎性尿所見と同時に,3カ月以内に30%以上の腎機能の悪化がある場合にはRPGNを疑い,専門医への紹介をすすめる.新たに出現した尿異常の場合,RPGNを念頭において,腎機能の変化がないかを確認するべきである.
2)確定診断のための指針:
①病歴の聴取,過去の検診,その他の腎機能データを確認し,数週から数カ月の経過で急速に腎不全が進行していることの確認.②血尿(多くは顕微鏡的血尿,まれに肉眼的血尿),蛋白尿,赤血球円柱,顆粒円柱などの腎炎性尿所見を認める.以上の2項目を同時に満たせば,RPGNと診断することができる.なお過去の検査歴などがない場合や来院時無尿状態で尿所見が得られない場合は臨床症候や腎臓超音波検査,CTなどにより,腎のサイズ,腎皮質の厚さ,皮髄境界,尿路閉塞などのチェックにより,慢性腎不全との鑑別を含めて,総合的に判断する.
3)病型診断:
可能な限り速やかに腎生検を行い,確定診断と同時に病型診断を行う.あわせて血清マーカー検査や他臓器病変の評価により二次性を含めた病型の診断を行う.
鑑別診断
鑑別を要する疾患としては,慢性腎不全の急性増悪や様々な急性腎不全をきたす疾患があげられる.また,急性間質性腎炎,悪性高血圧症,強皮症腎クリーゼ,コレステロール塞栓症,溶血性尿毒症症候群などがあげられる.
合併症
経過中に腎以外の全身性の血管炎症候を合併症することがある.頻度の高いものとしては,肺出血,脳出血,脳梗塞,心筋梗塞,消化管出血,末梢神経障害,皮膚潰瘍などがあげられる.
また,患者が中高齢者であることが多く,治療の主体が免疫抑制療法であることから,日和見感染を含めた重篤な感染症を併発する場合がある.このような感染症による死亡が本症の死亡原因の半数以上を占める(Koyamaら, 2009).
経過・予後
MPO-ANCA陽性のRPGNの6カ月時点での腎生存率は1998年以前69.7%,1999〜2001年76.5%,2002年以降,78.9%と近年有意に腎予後が改善している.また治療開始から6カ月間の生存率については1998年以前77.5%,1999〜2001年80.4%,2002年以降,86.0%で改善傾向を認めている(Koyama ら,2009).治療開始時の腎機能が生命予後,腎予後にも影響するため,腎機能が高度に悪化する以前の早期診断に努めることがきわめて重要である.そのほか,肺出血や間質性肺炎などの肺合併症を伴う症例の生命予後が不良であることがわかっている(Yamagataら,2012).
治療
入院安静を基本とする.本症の発症・進展に感染症の関与があること,日和見感染の多さなどから,環境にも十分配慮し,可能な限り感染症の合併を予防することが必要である.
RPGNはさまざまな原疾患から発症する症候群であり,その治療も原疾患により異なる.ANCA陽性のpauci-immune型RPGNの治療法を中心に示す.治療の基本は副腎皮質ステロイド薬と免疫抑制薬による免疫抑制療法である.初期治療は,プレドニゾロン0.6~0.8 mg/日で開始し,高度の炎症所見や多臓器の病変を伴う場合には,メチルプレドニゾロンの大量静注(パルス)療法が行われる.若年の患者にはシクロホスファミド(経口あるいは静注)の併用を考慮する.初期治療で疾患の活動性をコントロールできた場合には,プレドニゾロンの投与量を4~8週以内に20 mg/日未満に減量する.病状に応じ,抗血小板薬,抗凝固薬を併用するが,出血合併症に対しては十分な注意が必要である.治療抵抗例,副作用などにより十分な免疫抑制療法を行えない場合,肺出血合併例には,血漿交換療法などが行われる.
また日和見感染症は呼吸不全により発症することが多い.免疫抑制療法中には,ST合剤(1~2 g 48時間ごと,医薬品適応外使用)の投与や,その他の感染症併発に細心の注意をはかる.[山縣邦弘]
■文献
Koyama A, Yamagata K, et al: A nationwide survey of rapidly progressive glomerulonephritis in Japan: etiology, prognosis and treatment diversity. Clin Exp Nephrol, 13: 633-650, 2009.
Yamagata K, Usui J, et al: ANCA-associated systemic vasculitis in Japan: clinical features and prognostic changes. Clin Exp Nephrol, 16: 580-588, 2012.
出典 内科学 第10版内科学 第10版について 情報