化学辞典 第2版 「テトラヒドロホウ酸塩」の解説
テトラヒドロホウ酸(1-)塩
テトラヒドロホウサンエン
tetrahydroborate
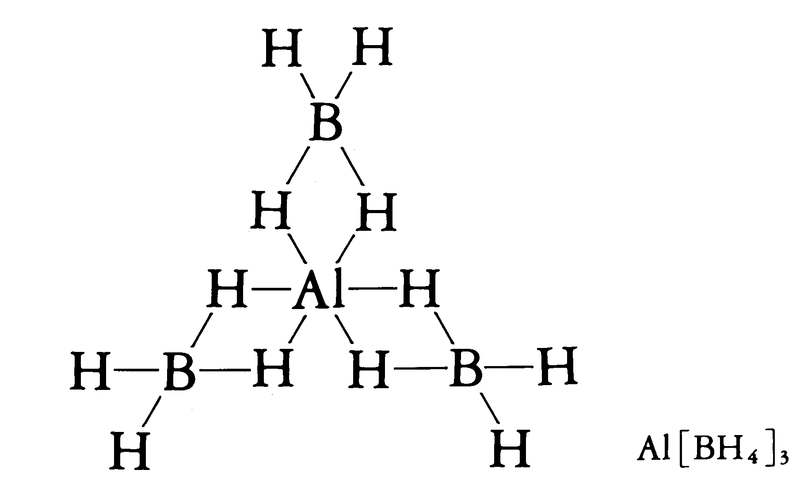
Mn+ [BH4]n(n = 1~4).いずれも [BH4]- を含む.n = 1ではイオン結晶であるが,n ≧ 2では,MにBH4がそのHで配位結合している.【Ⅰ】n = 1:MⅠ[BH4](M = Li,Na,K,Rb,Cs).Li,Na塩は,MHとB2H6,BF3,ホウ酸メチルなどとの反応で得られる.通称,水素化ホウ素ナトリウムNaBH4(37.83)は,実用性があり,工業的には,ホウ砂,けい砂,Naの混合物と加圧水素を450~500 ℃ で反応させて合成し,液体アンモニアで抽出し,溶媒を蒸発させると得られる.K,Rb,Cs塩は,各金属塩とNa塩を水溶液またはエタノール溶液中で複分解すると得られる.たとえばNa[BH4]は,25 ℃ では立方晶系で,過塩素酸ナトリウム型構造.四面体型のBH4-を含む.B-H約1.29 Å.-83 ℃ 以下では正方晶系となる.いずれもイオン結晶で,空気中でも比較的安定である.NaBH4は無色の結晶で,乾燥空気中ではかなり安定であるが,加熱すると燃える.水に可溶.pH < 7ではすみやかに加水分解して水素を発生するが,pH > 7では分解は遅い.さらに pH > 9では,二水和物の結晶も得られる.ほかのアルカリ金属塩も類似の性質をもつ.NaBH4は,有機合成などで還元剤に用いられるほか,有機薬品中にまじったアルデヒド,ケトン,過酸化物などのスカベンジャーとしても利用される.そのほか,ゴムの発泡剤,水素やジボランの発生用にも利用される.Li塩も還元剤や他金属のテトラヒドロホウ酸塩の製造などに用いられる.[CAS 16940-66-2:NaBH4]【Ⅱ】n = 2:MⅡ [BH4]2(M = Be,Mg,Ca,Sr,Ba).Be塩は,BeCl2とLiBH4との反応で,Mg~Ba塩は,各金属の水素化物とジボランをエーテルやTHF中で反応させると得られる.Be[BH4]2は,無色の正方晶系結晶.空気や水とも反応しやすい.各Beは3個のBH4がそれぞれ2個のH原子でキレート配位し,三方柱型六配位し,全体として巨大分子を形成している.Be-B1約1.92 Å,Be-B22.00 Å,Be-H約1.6 Å,B-H約1.1 Å.気体では単量体である.Mg塩は,Be塩よりは安定で,空気との反応は遅いが水と反応する.Ca,Sr,Ba塩はさらにイオン性を増し,より安定である.【Ⅲ】n = 3:MⅢ [BH4]3(M = Al,Ga,In,Tl).Al,Ga塩は,各塩化物とLiBH4との反応,またAl~In化合物は,各金属のトリメチル化合物と,B2H6の反応でも得られる.Al塩は,気体は単量体で,Alに3個のBH4が,それぞれ2個のH原子でキレート配位し,三方柱型六配位である.固体Al塩は,融点-64.5 ℃,沸点44.5 ℃.反応性が大きく,水やHClとはげしく反応して水素を発生し,空気に触れると発火する.付加化合物(Al[BH4]3・N(CH3)3,Al[BH4]3・P(CH3)3など)は比較的安定である.Al塩は,還元剤として有機合成に用いられるほか,重金属のテトラヒドロホウ酸塩合成の原料,ジェットエンジンやロケットの燃料の添加剤にも用いられる.【Ⅳ】n = 4:MⅣ [MH4]4(M = Zr,Hf,Th,U).Zr塩は,ZrCl4とLiBH4との反応で得られる.ただし,TiCl4とLiBH4では,TiⅢ [BH4]3となってしまう.Zr塩は,-169 ℃ の結晶では,ZrのまわりにBH4がほぼ正四面体型に配列し,それらの12個のH原子が配位している.Zr…B約2.34 Å.融点28.7 ℃,沸点123 ℃.空気中では燃えやすく,水とはげしく反応する.Hf~Uの塩もむしろ共有結合性が強い.U塩は昇華性がある.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報